
题目列表(包括答案和解析)
23.(4分)某一反应体系有反应物和生成物的粒子共六种:SO 、I2、、H+、SO
、I2、、H+、SO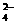 、I-、H2O。已知该反应中I2只发生如下过程:I2→I-,请回答。
、I-、H2O。已知该反应中I2只发生如下过程:I2→I-,请回答。
(1)该反应中的还原剂是 (填分子或离子符号)。
(2)写出该反应的离子方程式
。
(3)若利用该反应原理进行滴定操作,则应选择的指示剂为 (填序号)。
A.淀粉溶液 B.酚酞 C.甲基橙
22.右图是某学校实验室从化学试剂商店买回
的硫酸试剂标签上的部分内容。据此下列
|
A.该试剂的物质的量浓度9.2mol·L-1
B.该硫酸50mL与足量的铜反应,被氧化
的铜的物质的量为0.46mol
C.配制250mL 9.2mol·L-1的稀硫酸需取
该硫酸125 mL
D.该硫酸与等体积的水混合所得溶液的
质量分数小于49%

 08届高三化学第一学期期中考试
08届高三化学第一学期期中考试
化 学 试 卷
第Ⅱ卷(非选择题 共51分)
21.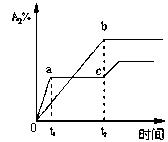 反应:A2+B2
反应:A2+B2 2AB ;△H,在不同温度和压强条件下,反应物A2的变化情况,如下图所示:a为500℃的变化情况,b为300℃时的变化情况,c为500℃时,从时间t2开始向容器中加压的情况。则下列叙述正确的是[ ]
2AB ;△H,在不同温度和压强条件下,反应物A2的变化情况,如下图所示:a为500℃的变化情况,b为300℃时的变化情况,c为500℃时,从时间t2开始向容器中加压的情况。则下列叙述正确的是[ ]
A.A2、B2、AB均为气体,△H>0
B.A2、AB均为气体,B2为固体或液体,△H>0
C.A2、B2、AB均为气体,△H<0
D.A2、AB均为气体,B2为固体或液体,△H<0
20.灰锡(以粉末状存在)和白锡是锡的两种同素异形体。
已知:①Sn(s、白)+2HCl(aq)=SnCl2(aq)+H2(g);DH1
②Sn(s、灰)+2HCl(aq)=SnCl2(aq)+H2(g);DH2
③Sn(s、灰)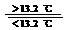 Sn(s、白);DH3=+2.1 kJ/mol
Sn(s、白);DH3=+2.1 kJ/mol
下列说法正确的是[ ] (07年高考广东化学卷)
A.DH1>DH2
B.锡在常温下以灰锡状态存在
C.灰锡转化为白锡的反应是放热反应
D.锡制器皿长期处于低于13.2 ℃的环境中,会自行毁坏
19.下列实验不能达到目的的是[ ]
|
序号 |
实验目的 |
实验操作 |
|
A |
测定某溶液的pH |
用玻璃棒蘸取该溶液点在pH试纸中间 |
|
B |
加快锌与稀硫酸反应制取
H2的速率 |
在稀硫酸中滴加少量CuSO4溶液 |
|
C |
证明醋酸是弱电解质 |
往CH3COONa溶液中滴入酚酞试液, 观察溶液颜色的变化 |
|
D |
制取无水AlCl3 |
加热蒸发AlCl3溶液 |
18.根据相关化学原理,下列判断正确的是[ ]
A.若X是原子晶体,Y是分子晶体,则熔点:X<Y
B.若A2+2D-→2A-+D2,则氧化性:D2>A2
C.若R2-和M+ 的电子层结构相同,则原子序数:R>M
D.若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的碱性:NaA<NaB
17.在25 ℃时,将pH = 11的NaOH溶液与pH = 3的CH3COOH溶液等体积混合后,下列关系式中正确的是[ ] (07年高考理综四川卷)
A.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.c(H+) = c(CH3COO-)+c(OH-)
D.c(Na+) = c(CH3COO-)+c(CH3COOH)
16.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾
溶液为电解液,电池总反应式为: Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s) ,
则下列说法错误的是[ ]
A.电池工作时,锌失去电子
B.电池工作时,电子由正极通过外电路流向负极
C.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-=Mn2O3(s)+2OH-(aq)
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
15.下列关于盐酸与醋酸两种稀溶液的说法正确的是[ ] (07年高考上海化学卷)
A.相同浓度的两溶液中c(H+)相同
B.100 mL 0.1 mol/L的两溶液能中和等物质的量的氢氧化钠
C.pH=3的两溶液稀释100倍,pH都为5
D.两溶液中分别加入少量对应的钠盐,c(H+)均明显减小
14.用已知浓度的NaOH溶液滴定待测浓度的盐酸(盐酸置于锥形瓶中),以下操作会造成所测
盐酸溶液浓度偏高的是[ ]
A.碱式滴定管未用待装溶液润洗 B.酸式滴定管未用待装溶液润洗
C.锥形瓶未用待装溶液润洗 D.滴定后,俯视滴定管读数
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com