
题目列表(包括答案和解析)
16.无水CuSO4在强热下会发生分解反应: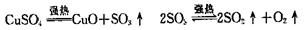
某研究性学习小组设计了下图所示装置(夹持仪器已略去),利用D管在反应前后的质量差计算分解的无水CuSO4的质量。

实验步骤:
①称量反应前D管的质量。
②连接好装置,关闭K,加热硬质玻璃管A一定时间后,停止加热。
③待硬质玻璃管A冷却后,打开K,通人一段时间的空气。
④再称量D管,得其反应前后的质量差为m。
(1)B管中出现的现象是_______________有关离子方程式是_____________________________
(2)B管的作用是除去混合气体中的SO3,实验过程中发现B管的温度明显升高,主要原因是
___________________________________________________________________,
(3)按上述方法实验,假设B、C、D对气体的吸收均完全,并忽略空气中CO2的影响,能否根据m计算分解的无水CuSO4的质量?
原因是 。
15.某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了下图所示装置。打开分液漏斗D中活塞,缓慢加入稀盐酸至过量,与固体M充分反应。待反应停止后,B中有黑色沉淀析出,C中量气装置右边液面上升,调节量气装置使左右液面相平后,测得进入C中的气体为V mL(已换算成标准状况)。

根据上述实验事实,回答下列问题:
(1)加入药品和实验开始前必须进行的操作是 ____;
(2)固体M中一定有的物质是 (写化学式)。
(3)写出A中发生反应的化学方程式(只写一个): ______;
(4)写出B中析出黑色沉淀时发生反应的离子方程式 _____;
(5)根据题给条件,固体M中一种物质的质量可以确定,应为 g(用代数式表示)。
(6)稀盐酸与固体M反应后还残留淡黄色固体,该固体可能是 (写化学式),要分离该固体,在实验操作中,除烧杯、玻璃棒外,还需要的玻璃仪器是 。
(7)反应完成后,取A中溶液少许加入试管中,要确定固体M中是否含有Fe3+,需加入的试剂为: 。
A.KSCN溶液 B.NaOH溶液 C.氨水
14.硫与热强碱溶液可生成S2-和SO32-;生成物继续与硫作用分别得Sz2-和S2O32-。过滤后除去过量硫,向滤液中加入一定量的强碱后,再通入足量的SO2,SO2与Sx2-也完全转化为S2O32-。问:
(1)S+SO2+OH-完全转化为S2O32-的离子方程式___________________________________;
(2)amolS最终转化为Na2S2O3,需SO2、NaOH的物质的量分别为__________________;
(3)若amolS最终转化为Na2Sx耗原热碱溶液6molNaOH,则Na2Sx中x值为_________。
13.化学工业在国民经济中占有极其重要的地位,硫酸是许多化学工业的原料。也是国家工业发达水平的一种标志。
(1)硫酸生产中,根据化学平衡原理来确定的条件或措施有____________(填序号)。
A.矿石加入沸腾炉之前先粉碎 B.使用V2O5作催化剂
C.接触室中不使用很高的温度 D.净化后炉气中要有过量的空气
E.接触氧化在常压下进行 F.吸收塔中用98.3%的浓硫酸吸收SO3
(2)硫酸工业的尾气中含有少量的SO2,常用过量氨水吸收,写出该反应的离子方程式:
________。
(3)如果将一定体积的尾气(不考虑三氧化硫)通入100mL3mol/L的NaOH溶液中使其完全反应,经低温低压蒸得固体23.0克,通过计算确定所得固体物质的成分及其物质的量。
12.A、B、C、D、E都是短周期元素,原子序数依次增大,B、C同周期,A、D同主族。A、B 能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1。E的单质既能与强酸反应,也能与强碱反应。根据以上信息回答下列问题:
(1)甲、乙两分子中含有非极性共价键的物质的结构式是______________________,C元素在周期表中的位置是__________________。
(2)C和D的离子中,半径较小的是__________(填离子符号)。
(3)将D的单质投入甲中,待D消失后再向上述溶液中加入E的单质,此时发生反应的化学方程式是____________________________________________________。
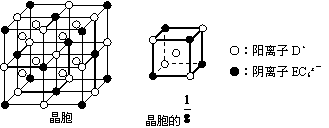 (4)C、D、E可组成离子化合物DxEC6,其晶胞结构如下图所示,阳离子
(4)C、D、E可组成离子化合物DxEC6,其晶胞结构如下图所示,阳离子
D+位于正方体的棱的中点和正方体内部;阴离子EC6x-位于该正方体的顶点和面心。该化合物的化学式是:___________________。
11.工业上将硫黄混入Na2SO3溶液中共热至沸可制取Na2S2O3。制备Na2S2O3的另一种方法是把SO2不断通入Na2S和Na2CO3的混合液中,在反应过程中,先生成黄色沉淀,其量逐渐增多,然后又逐渐减少。当形成无色透明溶液时,反应完成:(提示:H2SO3酸性比H2S、H2CO3、H2S2O3强;H2S2O3为弱酸,不稳定H2S2O3=S+SO2+H2O)
(1)写出用上述反应制备Na2S2O3的化学方程式
①______________________________ ②_______________________________
 ③______________________________
④Na2SO3+S △ Na2S2O3
③______________________________
④Na2SO3+S △ Na2S2O3
(2)原料中Na2CO3、Na2S、SO2的物质的量比最佳是___________________。
(3)若SO2过量,则又会有黄色沉淀出现,其原因是(用离子方程式表示)
_______________________________________。
9.(1)将一定量的铁粉和硫粉的混合物共热(隔绝空气),充分反应后冷却,再加入足量H2SO4,得到标准状况下的气体11.2 L,则:
①当n(Fe)=n(S)时,混合物总质量______44g;(填“<”“>”或“=”下同)
②当混合物总质量大于44g时,n(Fe)______n(S)。
(2)实验室将Na2SO3和NaClO3按物质的量的比1:2倒入烧杯中,同时加入适量硫酸,并用水浴加热,产生棕黄色气体X,反应后测得Na2SO3和NaClO3恰好完全反应,则X的化学式为_____________。
(3)将含a mol Na2S的溶液和含b mol Na2S2O3的溶液混合,然后加入H2SO4酸酸化。酸化后溶液无任何气体逸出。由此推知a:b为____________。
(4)工业上用硫铁矿制硫酸,若制SO2时损失4%的硫,接触氧化时SO2的转化率为90%,SO3与水作用生成硫酸时,硫酸的产率为98%,则生产150 t溶液里溶质的质量分数为96%的浓硫酸,需纯度80%的硫铁矿___________吨。(保留一位小数)
 10.下列关系中,A为正盐,C的相对分子质量比D的相对分子质量小16;E是一种酸,且E可用于配制王水;A、B、C、D、E中均含同一种元素;在含盐酸的品红溶液中加入A盐后,可使品红溶液褪色;向该溶液中加入一定量的X后;加热溶液又变成红色,常温时,0.1 mol/L的X溶液的pH=13。
10.下列关系中,A为正盐,C的相对分子质量比D的相对分子质量小16;E是一种酸,且E可用于配制王水;A、B、C、D、E中均含同一种元素;在含盐酸的品红溶液中加入A盐后,可使品红溶液褪色;向该溶液中加入一定量的X后;加热溶液又变成红色,常温时,0.1 mol/L的X溶液的pH=13。
根据上述材料,回答下列问题:
(1)A是______Y是_________,
(2)X可能是____________,
(3)写出E与甘油在一定条件下反应的化学方程式:__________________________________。
8.在一定条件下,硫酸铵的分解反应为:4(NH4)2SO4=N2↑+6NH3↑+3SO2↑+SO3↑+7H2O,
当有nmol电子转移时,下列说法不正确的是
A.有 (NH4)2SO4分解 B.有
(NH4)2SO4分解 B.有 原子被还原
原子被还原
C.生成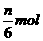 氧化产物 D.生成7nmolH2O
氧化产物 D.生成7nmolH2O
7.FeS2的结构类似于Na2O2,是一种过硫化物,与酸反应生成H2S2,H2S2类似于H2O2,易分解:H2S2=H2S↑+S↓,实验室制取H2S时,某学生误将FeS2颗粒当作FeS使用,当FeS2 反应完全后,不可能生成的物质为:①H2S ②S ③FeS ④FeCl3
A.①③ B.②③④ C.③④ D.①③④
6.接触法制硫酸工业生产中,在吸收塔内用浓硫酸吸收SO3可得到H2SO4·SO3,若用1 kg 98%的
H2SO4充分吸收SO3后再进行稀释,可得98%的H2SO4
A.2.22 kg B.2.42 kg
C.2.6kg D.2.77kg
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com