
题目列表(包括答案和解析)
4. 将氨水滴加到盛有AgCl的试管中,AgCl逐渐溶解,对上述过程,下列叙述或解释中正确的有
A. 所得溶液中c(Ag+)×c(Cl-)>Ksp(AgCl)
B. 所得溶液中形成了更难电离的物质
C. 上述实验说明Cl-与NH4+间有很强的结合力
D. 上述过程中NH3·H2O的电离程度增大
3. 根据热化学方程S ( s ) + O2 ( g ) = SO2 ( g ) △H =-297.23 kJ/mol (反应在298K,101kPa下发生)分析下列说法不正确的是
A. 标况下,燃烧1mol S放出的热量为297.23 kJ
B. S ( g ) + O2 ( g ) = SO2 ( g ) △H< -297.23 kJ/mol
C. 在密闭容器中1mol固态S 与1molO2 反应放出的热量小于297.23 kJ
D. 形成1 mol SO2 的化学键所释放的总能量大于断裂 1 molS ( s )和 1mol O2 ( g )的化学键所吸收的总能量
2. 关于化学平衡常数的叙述正确的是
A.一个化学反应的平衡常数是一个常数
B.两种物质反应,不管怎样书写化学方程式,平衡常数不变
C.温度一定时,对于给定的化学反应,正、逆反应的平衡常数互为倒数
D.浓度商Qc<Kc,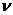 正 <
正 <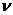 逆
逆
1. 一个可逆的化学反应能否进行得完全,其根本因素是 ( )
A.温度 B.反应物的浓度
C.参加反应的各物质的性质 D.催化剂的加入
16.(12分)A-J是中学化学中常见的几种物质,它们之间的转化关系如下图所示。已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F化合生成,J可作禽流感、SARS等病毒的杀菌消毒剂。

(1)写出E、B的电子式:B_______________。E 。
(2)写出反应⑦的离子方程式:_________________________________。
(3)向AlCl3溶液中加入少量固体B,写出反应的化学方程式:____________________________________________________________。
(4)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则阳极的电极反应式为:__________________。_____________极(填“阴”或“阳”)附近溶液由无色变为红色。
15.(16分)X、Y、Z为短周期元素的单质,U、V为它们的化合物,这些物质之间的关系如图5-3所示,其中反应条件和某些产物已经略去:
(1)如果X、Y的组成元素是同主族的,写出反应Ⅰ的化学反应方程式:
①若已知V是水:___________________________;
 ②若已知U、V均为氧化物_________________________。
②若已知U、V均为氧化物_________________________。
(2)如果X、Y的组成元素不同主族时,按下列要求回答问题。
①X组成元素是地壳中含量最多的金属元素时,则X、Y、Z的化学式是:X为____________;Y为_____________;Z为___________。
②若Y组成元素在自然界中形成的化合物种类最多时,则V、U的化学式是:V为______________;U为_____________。
③若Z是通常情况下密度最小的物质,则反应Ⅰ的化学反应方程式:
_______________________________________________。
14.(18分)已知X、Y、Z、W是元素周期表中短周期中的四种非金属元素,它们的原子数依次增大,X元素的原子形成的阳离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。试回答:
(1)写出下列元素的元素符号
X 、Y 、Z 、W 。
(2)X单质和Z单质在一定条件下反应生成化合物E,该反应的化学方程式为(请注明反应条件) 。E分子的空间构型为 ,电子式为 。E在催化剂存在的条件下可用于还原汽车尾气中的 ,以减少对大气的污染。
(3)仅由X、Z、W三种元素组成的某种盐是一种速效肥料,但长期施用会使土壤酸化,有关的离子反应方程式为 。
(4)这四种元素可组成原子个数比为5∶1∶1∶3的化合物(按X、Y、Z、W的顺序),该化合物的水溶液与足量NaOH溶液反应的离子方程式 。
(5)将9g单质Y在足量W单质中燃烧,所得气体通入lL lmol·L-1NaOH溶液中,完全吸收后,溶液中的各离子浓度由大到小的顺序是 。
13.(07年高考理综重庆卷 ) (14分) a、b、c、d、e是短周期元素,周期表中a与b、b与c相邻;a与e的最外层电子数之比为2:3,b的最外层电子数比e的最外层电子数少1个;常见化合物d2c2与水反应生成c的单质,且溶液使酚酞试液变红。
(1) e的元素符号是__________。
(2)a、b、c的氢化物稳定性顺序为(用分子式表示)______________________;b的氢化物和b的最高价氧化物的水化物反应生成Z,则Z中的化学键类型为_________________,Z的晶体类型为_____________;ab-离子的电子式为____________。
(3)由a、c、d形成化合物的水溶液显碱性,其原因是(用离子方程式表示)______________________________________________。
(4)一定量的d2c2与ac2反应后的固体物质,恰好与0.8 mol稀盐酸溶液完全反应,并收集到0.25 mol气体,则用物质的量表示该固体物质的组成为__________________、___________________。
12.下列说法中正确的是 ( )
A.金属Na、Mg、Al的硬度依次降低 B.HI、HBr、HCl、HF的沸点依次降低
C.氯化钠和氯化氢溶于水时,破坏的化学键都是离子键
D.C60气化和I2升华克服的作用力相同
11.下列说法正确的是 ( )
A.常温常压下,只有一种元素的单质呈液态
B.周期表中所有元素都是从自然界中发现的 C.过渡元素不全是金属元素
D.常温常压下,气态单质的分子都是由非金属元素的原子形成的
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com