
题目列表(包括答案和解析)
24.(13分)25℃时,将0.01 mol CH3COONa和0.002 mol HCl溶于水,形成1 L混合溶液:
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
① ;
② ;
③ 。
(2)溶液中共有 种不同的粒子(指分子和离子)。
(3)在这些粒子中,浓度为0.01 mol·L-1的是 ,浓度为0.002 mol·L-1的是 。
(4) 和 两种粒子物质的量之和等于0.01 mol。
(5) 和 两种粒子物质的量之和比氢离子数量多0.008 mol。
23.(15分)利用太阳光分解水制氢是未来解决能源危机的理想方法之一。某研究小组设计了如右图所示的循环系统实现光分解水制氢。反应过程中所需的电能由太阳能光电池提供。
⑴ 从图中可见,反应体系中____________ 可循环使用
⑵ 写出电解池A、电解池B和光催化反应池中反应的离子方程式。
电解池A______________________________________________________________
电解池B_______________________________________________________________
光催化反应池__________________________________________________________
⑶ 若电解池A中生成3.36 L H2(标准状况),则电解池B中生成Fe2+的物质的量为______。
22.(14分)化学在能源开发与利用中起着十分关键的作用。
(1)蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体,我国南海海底有极其丰富的“可燃冰”资源。
①“可燃冰”从海底取出后,将融化并放出甲烷气体。试解释其原因:
。
②取356g分子式为CH4·9H2O的“可燃冰”,将其释放的甲烷完全燃烧生成液态水,可放出1780.6kJ的热量,则甲烷的燃烧热为 ,甲烷燃烧的热化学方程式为 。
(2)设计出能使液化石油气氧化直接产生电流的燃料电池是新世纪最富有挑战性的课题之一。最近有人制造了一种燃料电池,一个电极通入空气,另一电极通入液化石油气(以C4H10表示),电池的电解质是掺入了Y2O3的ZrO2晶体,它在高温下传导O2-。
①已知该电池的负极反应为: ,则该电池的正极反应为
,电池工作时,固体电解质里的O2-向
极移动。
,则该电池的正极反应为
,电池工作时,固体电解质里的O2-向
极移动。
②液化石油气电池最大的障碍是氧化还原反应不完全而产生的 (填写物质的名称)堵塞电极的气体通道。
(3)能源的紧缺在很大程度上制约着经济的发展,请你提出解决能源紧缺问题的两点建议 。

21.(18分)(工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g)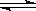 2NH3(g),△H = -92.44kJ/mol;其部分工艺流程如下:
2NH3(g),△H = -92.44kJ/mol;其部分工艺流程如下:

反应体系中各组分的部分性质见下表:
|
气体 |
氮气 |
氢气 |
氨 |
|
熔点(℃) |
-210.01 |
-252.77 |
-77.74 |
|
沸点(℃) |
-195.79 |
-259.23 |
-33.42 |
回答下列问题:
(1)写出该反应的化学平衡常数表达式:K= 。随着温度的升高,K值 (填增大、减小、不变)。
(2)平衡常数K值越大,表明 (填序号)。
A.N2的转化率越高 B.NH3的产率越大 C.原料中N2的含量越高 D.化学反应速率越快
(3)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过把混合气体的温度降低到 使 分离出来;继续循环的气体是 。
20.已知反应:
 ①101Kpa时,2C(s)+O2(g)
2CO(g);△H= -221 kJ/mol
①101Kpa时,2C(s)+O2(g)
2CO(g);△H= -221 kJ/mol
 ②稀溶液中,H+(aq)+OH-(aq)
H2O(1);△H= -57.3kJ/mol
②稀溶液中,H+(aq)+OH-(aq)
H2O(1);△H= -57.3kJ/mol
下列结论正确的是
A.碳的燃烧热大于110.5 kJ/mol
B.①的反应热为221 kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
19.锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时的电极反应式为
负极反应:C6Li-xe-===C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成的复合材料)
正极反应:Li1-xMO2+xLi++x e-===LiMO2(LiMO2表示含锂的过渡金属氧化物)
下列有关说法正确的是
A.锂离子电池充电时电池反应为C6Li+Li1-xMO2===LiMO2+C6Li1-x
B.电池反应中,锂、锌、银、铅各失去1mol电子,金属锂所消耗的质量最小
C.锂离子电池放电时电池内部Li+向负极移动
D.锂离子电池充电时阴极反应为C6Li1-x+xLi++x e-===C6Li
18.当电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和碳酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法不正确的是 ( )
A.当电池负极消耗mg气体时,电解池阳极同时有mg气体生成
B.电池的正极反应式为:O2 + 2H2O + 4e- = 4OH-
C.电解后c(Na2CO3)不变,且溶液中有晶体析出
D.电池中c(KOH)变小,电池中溶液pH减小
17.已知25℃时,AgI饱和溶液中c (Ag+)为1.22×10-8mol/L,AgCl的饱和溶液中c (Ag+)为1.25×10-5mol/L。若在5mL含有KCl和KI各为0.01mol/L的溶液中,加入8mL0.01mol/LAgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确是
A.c (K+)>c (NO3-) >c (Cl-) >c (Ag+)>c (I-)
B. c (K+)>c (NO3-) >c (Ag+) >c (Cl-)>c (I-)
C. c (NO3-)>c (K+)>c (Ag+) >c (Cl-)>c (I-)
D. c (K+)>c (NO3-) >c (Ag+) = c (Cl-) + c (I-)
16.已知0.1 mol / L 的二元酸H2A溶液的pH=4.0,则下列说法中正确的是
A. 在Na2A、NaHA两溶液中,离子种类不相同
B. 在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
C. 在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2 c(A2-)
D. 在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-)
15.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:还原性Fe>Ni>Cu) ﹙ ﹚
A.阳极发生还原反应,其电极反应式:Ni2+ + 2e- == Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com