
题目列表(包括答案和解析)
16、平衡体系H2CO3 H++HCO3-和HCO3-
H++HCO3-和HCO3- H++CO32-中,PH值增大时,[CO32-]将( )
H++CO32-中,PH值增大时,[CO32-]将( )
A.增大 B.减小 C.不变 D.可能增大也可能减小
15、(2007年高考江苏卷,电解)某同学按图所示的装置进行电解实验。下列说法正确的是( )
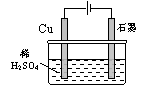 (A)电解过程中,铜电极上有H2产生
(A)电解过程中,铜电极上有H2产生
(B)电解初期,主反应方程式为:Cu+H2SO4 CuSO4+H2↑
CuSO4+H2↑
(C)电解一定时间后,石墨电极上有铜析出
(D)整个电解过程中,H+的浓度不断增大
13、(2007年高考重庆卷)如图所示,下列叙述正确的是( )
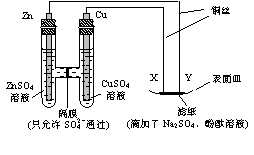
(A)Y为阴极,发生还原反应
(B)X为正极,发生氧化反应
(C)Y与滤纸接触处有氧气生成
(D)X与滤纸接触处变红
14(2007年高考上海化学卷)下列关于盐酸与醋酸两种稀溶液的说法正确的是( )
(A)相同浓度的两溶液中c(H+)相同 (B)pH=3的两溶液稀释100倍,pH都为5
(C)100 mL 0.1 mol/L的两溶液能中和等物质的量的氢氧化钠
(D)两溶液中分别加入少量对应的钠盐,c(H+)均明显减小
12、在密闭容器中通人一定量的HI气体,使其在一定条件下发生反应:
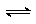 2HI H2+I2 (气) 。下列叙述中一定属于平衡状态的是
2HI H2+I2 (气) 。下列叙述中一定属于平衡状态的是
A.HI、H2、I2的浓度相等 B.混合气体的颜色不变化时
C.混合气体的总压不变时 D.v(HI):v(H2):v(I2)=2:1:1时
11、(2007年理综北京卷)在由水电离产生的H+浓度为1×10-13 mol/L的溶液中,一定能大量共存的离子组是( )
①K+、Cl-、NO3- 、S2-; ②K+、Fe2+、I-、SO42 -; ③Na+、Cl-、NO3- 、SO42 -
④Na+、Ca2+、Cl-、HCO3- ⑤K+、Ba2+、Cl-、NO3-
(A)①③ (B)③⑤ (C)③④ (D)②⑤
10、(2007年高考海南化学卷,阿伏加德罗定律)下列叙述正确的是( )
(A)一定温度、压强下,气体体积由其分子的大小决定
(B)一定温度、压强下,气体体积由其物质的量的多少决定
(C)气体摩尔体积是指1 mol任何气体所占的体积为22.4 L
(D)不同的气体,若体积不等,则它们所含的分子数一定不等
9、(2007年高考江苏卷)下列离子方程式书写正确的是( )
(A)过量的SO2通入NaOH溶液中:SO2+2OH- = SO32 -+H2O
(B)Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I- = 2Fe2++I2
(C)NaNO2溶液中加入酸性KMnO4溶液:2MnO4- +5NO2- +6H+ = 2Mn2++5NO3- +3H2O
(D)NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3- +Ba2++2OH- = BaCO3↓+2H2O+CO32 -
8、(2007年高考理综天津卷)25 ℃时,水的电离达到平衡:H2O H++OH-;DH>0,下列叙述正确的是( )
H++OH-;DH>0,下列叙述正确的是( )
(A)向水中加入稀氨水,平衡逆向移动,c(OH-)降低
(B)向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
(C)向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
(D)将水加热,KW增大,pH不变
7、(2007年高考上海化学卷,NA)设NA为阿伏加德罗常数,下列叙述中正确的是( )
(A)常温下11.2 L的甲烷气体含有甲烷分子数为0.5NA个
(B)14 g乙烯和丙烯的混合物中总原子数为3NA个
(C)0.1 mol/L的氢氧化钠溶液中含钠离子数为0.1NA个
(D)5.6 g铁与足量的稀硫酸反应失去电子数为0.3NA个
6、(2007年高考全国理综卷II)已知:①1 mol H2分子中化学键断裂时需要吸收436 kJ的能量
②1 mol Cl2分子中化学键断裂时需要吸收243 kJ的能量③由H原子和Cl原子形成1 mol HCl分子时释放431 kJ的能量,则下列叙述正确的是( )
(A)氢气和氯气反应生成氯化氢气体的热化学方程式是 H2(g)+Cl2(g) = 2HCl(g)
(B)氢气和氯气反应生成2 mol氯化氢气体,反应的DH = 183 kJ/mol
(C)氢气和氯气反应生成2 mol氯化氢气体,反应的DH =-183 kJ/mol
(D)氢气和氯气反应生成1 mol氯化氢气体,反应的DH =-183 kJ/mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com