
题目列表(包括答案和解析)
15.烟草不完全燃烧时产生的一氧化碳被吸进肺里跟血液中的血红蛋白(用Hb表示)化合,发生下述反应:CO+Hb·O2 O2+Hb·CO,实验表明,Hb·CO的浓度即使只有Hb·O2浓度的2%,也足以使人智力受损。当空气中的CO浓度较大时,人体就感到缺氧,胸闷,此时血液中羰基血红蛋白达到10%,通常人肺的血液中O2的溶解浓度达1.6×10-6mol/L,而其中血红蛋白的浓度稳定在8×10-6mol/L。而当过多的血红蛋白与一氧化碳结合时,就会因窒息而引起死亡。上述反应K为K=[O2][Hb·CO]/[CO][Hb·O2],K只限温度有关,与浓度无关。
O2+Hb·CO,实验表明,Hb·CO的浓度即使只有Hb·O2浓度的2%,也足以使人智力受损。当空气中的CO浓度较大时,人体就感到缺氧,胸闷,此时血液中羰基血红蛋白达到10%,通常人肺的血液中O2的溶解浓度达1.6×10-6mol/L,而其中血红蛋白的浓度稳定在8×10-6mol/L。而当过多的血红蛋白与一氧化碳结合时,就会因窒息而引起死亡。上述反应K为K=[O2][Hb·CO]/[CO][Hb·O2],K只限温度有关,与浓度无关。
(1)血红蛋白的生理学功能为
(2)一氧化碳使人中毒的机理为
(3)Hb与CO通过什么化学键结合成HbCO分子的? ,并判断Hb·CO分子与Hb·O2分子的稳定性强弱
(4)抽烟后,吸入肺部的空气测得CO和O2的浓度分别为10-6mol/L和10-2mol/L。已知37℃时,平衡常数K=220,这时Hb·CO的浓度是Hb·O2浓度的多少倍?这时候是否达到损伤人的智力的程度?请通过计算回答。
(5)设血红蛋白与O2反应的速率常数k=2.1×106L/mol s(37℃),求氧血红蛋白(Hb·O2)的生成速率。
(6)在一氧化碳中毒的情况下,需要将Hb·O2的生成速率提高到1.1×10-4L/mol s。
①假设血液中的血红蛋白浓度是恒定的,计算所需的氧的浓度。
②假设血液中的氧浓度与进入肺的氧分压成正比。试问用怎样的方法来治疗一氧化碳中毒的患者是合乎逻辑的?运用你所学的关于气体定律的知识和勒沙特列原理,设想一种增强这种治疗效果的方法。
14.560℃时,在恒容闭容器中发生如下反应:C(s)+H2O(g) CO(g)+H2(g)(正反应吸热)(1)请写出上述反应的平衡常数表达式
,若温度升高,则平衡常数_____(填“变大”、“变小”或“不变”)。
CO(g)+H2(g)(正反应吸热)(1)请写出上述反应的平衡常数表达式
,若温度升高,则平衡常数_____(填“变大”、“变小”或“不变”)。
(2)若560℃时,在恒容密闭容器中,若起始浓度[H2O]=0.03mol/L,当5秒钟时,测得
[H2O]=0.01mol/L,则前5秒钟H2的平均反应速率V(H2)=________________。
(3)能判断该反应是否达到化学平衡状态的依据是_____________。
A 容器中压强不变 B 混合气体中密度不变,C V正(H2)=V正(H2O) D c (CO)=c (H2)
(4)达到平衡后且恒容情况下,往容器中充入适量的H2S气体,重新达到平衡时,H2O的反应速率将______(填“增大”、“减小”或“不变”),理由是 。
13. 在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4
在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4 2NO2的平衡。下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
2NO2的平衡。下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
(1)计算在20至40秒时间内,NO2的平均生成速率
为 mol•L-1•S-1。
(2)该反应的化学平衡常数表达式为 。
(3)下表是不同温度下测定得到的该反应的化学平衡常数。
|
T/ K |
323 |
373 |
|
K值 |
0.022 |
0.36 |
据此可推测该反应(生成NO2)是 反应(选填“吸热”或“放热”)
(4)若其他条件不变,反应在423K时达到平衡,请在上图中找出相应的位置,添画出此温度下的反应进程曲线。
12.在一定条件下,二氧化硫和氧气发生如下反应:
2SO2(g)+O2(g) 2SO3(g)(正反应放热)
2SO3(g)(正反应放热)
(1)写出该反应的化学平衡常数表达式K=
(2)降低温度,该反应K值 ,二氧化碳转化率 ,化学反应速度 (以上均填增大、减小或不变)
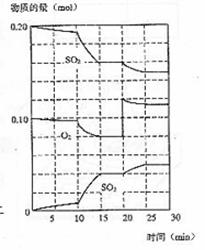
(3)600℃时,在一密闭容器中,将二氧化碳和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是 。
(4)据图判断,反应进行至20min时,曲线发生变化的原因是 (用文字表达);10min到15min的曲线变化的原因可能是 (填写编号)。
A 加了催化剂 B 缩小容器体积 C 降低温度 D 增加SO3的物质的量
11.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
(a)容器中压强不变 (b)混合气体中 c(CO)不变
(c)v正(H2)=v逆(H2O) (d)c(CO2)=c(CO)
 (4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为
℃。
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为
℃。
10.在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:
H2(g)+I2(g) 2HI(g)+Q(Q>0)
2HI(g)+Q(Q>0)
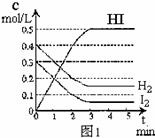
反应中各物质的浓度随时间变化情况如图1:
(1)该反应的化学平衡常数表达式为 ;
(2)根据图1数据,反应开始至达到平衡时,平均速率v(HI)为 ;
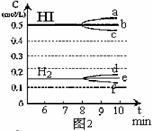
(3)反应达到平衡后,第8分钟时:
①若升高温度,化学平衡常数K(填写增大、减小或不变)HI浓度的变化正确 ;
(用图2中a-c的编号回答)
②若加入I2,H2浓度的变化正确的是 。(用图2中d-f的编号回答)
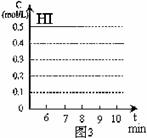
(4)反应达到平衡后,第8分钟时,若反容器的容积扩大一倍,请在图3中画出8分钟后HI浓度的变化情况。
9.在一定条件下,反应x
A+Yb zC达到平衡:
zC达到平衡:
(1)若A、B、C均为气体,则该反应的平衡常数表达式为_______________________;
(2)若A、B、C均为气体,减压后平衡向逆反应方向移动,则x、y、z间的关系是___________;
(3)已知C是气体,且x+y=z,在增大压强时,若平衡发生移动,则一定向________(填“正”或“逆”)反应方向移动;
(4)已知B、C是气体,当其他条件不变时,增大A的物质的量,平衡不移动,则A为______态 (5)加热后C的质量分数减少,则正反应是________(填“放热”或“吸热”)反应。升高温度达到新的平衡后,该反应的平衡常数将变__________(填“大”或“小”)。
8.平衡常数(K)是衡量某可逆反应在一定条件下反应进行程度的数值。一定温度下,可逆反应达平衡时,生成物浓度的反应系数次幂的乘积与反应物浓度的反应系数次幂的乘积之比值,即平衡常数。以2A+3B 3C+D为例,平衡常数的表达式为K={c(C)}3·{c(D)}/{c(A)}2·{c(B)}3。现往1L的容器中通入CO2、H2各2mol。在一定条件下让其发生反应:CO2+H2
3C+D为例,平衡常数的表达式为K={c(C)}3·{c(D)}/{c(A)}2·{c(B)}3。现往1L的容器中通入CO2、H2各2mol。在一定条件下让其发生反应:CO2+H2 CO+H2O,回答下列问题:
CO+H2O,回答下列问题:
(1)在830℃条件下,反应达到平衡时CO2的浓度为1mol/L。该条件下平衡常数K1 。
(2)在(1)基础上,把体系的温度降至800℃。已知该条件下的平衡常数K2=0.81,可以推知平衡时c(H2O)= (保留2位有效数字)。
(3)该可逆反应的正反应为 反应(填吸热或放热)。
(4)在(1)基础上,压缩容器体积至0.5L。该条件下的平衡常数为K3。则K3 K1(填“大于”“等于”“小于”)。理由是 。
7.已知可逆反应CO+H2O(g) CO2+H2,达到平衡时,K=
CO2+H2,达到平衡时,K= ,K是常数,只与温度有关,与浓度无关。
,K是常数,只与温度有关,与浓度无关。
(1)830K时,若起始时:c(CO)=2mol/L,c(H2O)=3mol/L,平衡时CO的转化率为60%,水蒸气的转化率为 ;K值为 。
(2)830K,若只将起始时c(H2O)改为6mol/L,则水蒸气的转化率为 。
(3)若830K时,起始浓度c(CO)=a mol/L,c(H2O)=b mol/L,H2的平衡浓度c(H2)=c mol/L,
①a、b、c之间的关系式是 ;②当a=b时,a= c。
6.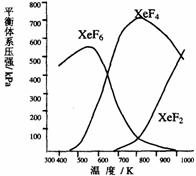 Xe和F2反应,可得三种氟化物,视反应条件而定。下图表述的是将0.125mol/L
Xe和1.225mol/L F2为始态得到的生成物在平衡体系内的分压与反应温度的关系。
Xe和F2反应,可得三种氟化物,视反应条件而定。下图表述的是将0.125mol/L
Xe和1.225mol/L F2为始态得到的生成物在平衡体系内的分压与反应温度的关系。
(1)应在什么温度下制备XeF2和XeF4?
(2)Xe和F2生成XeF6和XeF4,哪个反应放热更多?
生成 的反应放热更多。理由:
(3)为有效地制备XeF2,应在什么反应条件下为好?简述理由。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com