
题目列表(包括答案和解析)
22. (7分)某同学查资料得知α-AgI是一种固体导体,导电率很高。他为了研究α-AgI究竟是Ag+离子导电还是I-离子导电,设计一个如下图所示(用铅蓄电池做电源)的电化学实验。已知铅蓄电池总反应: Pb+PbO2+2H2SO4  2PbSO4+2H2O
2PbSO4+2H2O
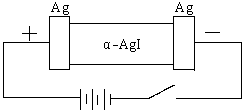
(1)该电解池的阳极电极方程式:
铅蓄电池的正极电极方程式:
(2)若Ag+导电,α-AgI本身质量将 。(填不变、变大、或变小)
若I-导电,阳极附近的α-AgI晶体密度将会 。(填不变、变大、或变小)
(3)若通电一段时间后铅蓄电池中消耗了1molH2SO4,则电解池的阴极增重 g。
21.(10分)2005年诺贝尔化学奖授予了三位科学家,以表彰他们在烯烃复分解反应研究方面所取得的成绩。已知烯烃的交叉复分解反应机理为双键断裂,换位连接。如:
|
 CH2=CH2+R1CH=CHR2
CH2=CH2+R1CH=CHR2
 又已知:①R-CH2-CH=CH2+Cl2
R-CHCl–CH=CH2+HCl
又已知:①R-CH2-CH=CH2+Cl2
R-CHCl–CH=CH2+HCl
②F是油脂水解产物之一,能与水任意比互溶;K是一种塑料;I的分子式为C9H14O6
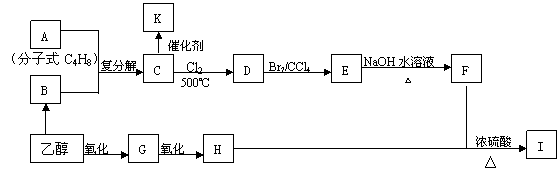
 请回答下列问题:
请回答下列问题:
(1)C4H8属于烯烃的同分异构体有 种;
(2)分子式为C4H8的所有烯烃通过烯烃复分解反应后生成的C5H10有 种结构
(3)请写出物质I的结构简式: ;
(4)写出下列反应方程式:C→D:
(5)K中的链节是 ;K属于 (线型、体型)结构
20. (12分)物质的转化关系如下图所示,其中甲可由两种单质直接化合得到,乙为金属单质,F的溶液中只含一种溶质,G为酸,乙在G的浓溶液中发生钝化。有的反应可能在水溶液中进行,有的反应中生成物未全部给出,反应条件也未注明。
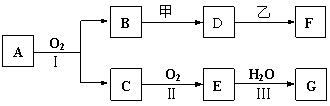
⑴若用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成;甲为一种淡黄色固体,D、F的溶液均呈碱性。则
①1.7 g A与O2反应生成气态的B和C时放出22.67 kJ热量,写出该反应的热化学方程式:_______________________________________________________________。
②B与甲反应的离子方程式是__________________________________ 。
③D的水溶液和F的水溶液中由水电离出的c(OH-)___________(填字母序号)。
(a)前者大 (b)后者大 (c)一样大 (d)不知浓度,无法比较
⑵若B为红棕色固体,C能使品红试液褪色,D的水溶液中加入HNO3酸化的AgNO3溶液有白色沉淀生成。则
①工业上反应Ⅰ在____________中进行,反应Ⅲ在___________(均填设备名称)中进行。
②由两种单质直接化合得到甲的反应条件是___________或_____________。
D和乙反应的离子方程式是______________________________ 。
19. (10分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e-=NO+2H2O
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:
(2)反应中硝酸体现了 、 性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是 mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:
(5)KMnO4在酸性溶液中发生还原反应的反应式:
18.(12分)某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
|
实验步骤 |
实验现象 |
|
将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中 |
产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
|
反应结束后分离出溶液备用 |
|
|
红色固体用蒸馏水洗涤后,置于潮湿空气中 |
一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3] |
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应:____________________________________;
化合反应:____________________________________。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可观察到的现象是_________________________________________。解释此现象的离子方程式是__________________________________________________。
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来冶炼金属锰。
①用铝与软锰矿冶炼锰的原理是(用化学方程式表示)___________________________。
②MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是________________________________。
17. (6分)下列实验操作能达到实验目的的是__________________(填代号)。
A.向沸水中滴入少量浓FeCl3溶液,煮沸至呈红褐色,制取Fe(OH)3胶体
B.向盛有稀HNO3的试管中加入铜片,稍稍加热,观察生成的NO气体
C.将pH试纸湿润后用于鉴别NH3和HCl两种刺激性气体
D.用滴管吸取NaOH溶液滴入久置的FeSO4溶液中,制取Fe(OH)2
E.将充有NO2气体的密闭玻璃球放入热水中,验证温度对化学平衡的影响
16. 常温下,下列有关叙述正确的是
A.Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
B.NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7mol/L
C.pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH4+)大小顺序
①=②>③
D.10mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≥20mL
15.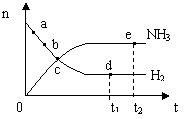 对于密闭容器中的反应:N2(g)+3H2(g)
对于密闭容器中的反应:N2(g)+3H2(g)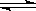 2NH3(g);
2NH3(g);
△H <0,在673K,30MPa下n(NH3)和n(H2)随时间变
化的关系如图所示。下列叙述正确的是
A.点a处的正反应速率比点b处的大
B.点 c处的正反应速率比逆反应速率大
C.点d (t1时刻) 的n(N2)比点 e (t2时刻) 处的n(N2)大
D.其他条件不变,773K下反应至t1时刻,此时画出的两根平行线间的距离将要变大
14. 设NA表示阿伏加德罗常数,下列说法中不正确的是
A.一定量的Fe与含1mol HNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA
B.1mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒
C.0.01molMg在空气中完全燃烧生成MgO和Mg3N2,转移电子数目为0.02NA
D.125gCuSO4·5H2O晶体中含有0.5NA个Cu2+
13. MnO2和Zn是制造干电池的重要原料,工业上用软锰矿和闪锌矿联合生产MnO2和Zn的基本步骤为:
⑴ 软锰矿、闪锌矿与硫酸共热: MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O。
 ⑵ 除去反应混合物中的不溶物
⑵ 除去反应混合物中的不溶物
⑶ 电解混合液MnSO4+ZnSO4+2H2O MnO2+Zn+2H2SO4
下列说法不正确的是
A.步骤⑴中MnO2和H2SO4都是氧化剂
B.步骤⑴中每析出12.8g S沉淀共转移0.8mol电子
C.电解时MnO2在阴极处产生
D.硫酸在生产中可循环使用
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com