
题目列表(包括答案和解析)
13.已知反应①2BrO3- + Cl2 =Br2 +2ClO3- ②5Cl2 + I2 +6H2O=2HIO3 +10HCl ③ClO3- +5Cl-+6H+=3Cl2 +3H2O,下列物质氧化能力强弱顺序正确的是( )C
A.ClO3->BrO3->IO3->Cl2 B.BrO3- >Cl2>C1O3->IO3-
C.BrO3->ClO3->Cl2>IO3- D.Cl2>BrO3->C1O3->IO3-
11、已知共轭二烯烃(两个碳碳双键间有一个碳碳单键)与烯烃或炔烃可发生反应生成六元环状化合物。如:1,3 ─丁二烯与乙烯反应可表示为:
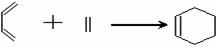
则异戊二烯(2 ─甲基─1,3 ─丁二烯)与丙炔反应,
生成产物的结构简式可能是( )
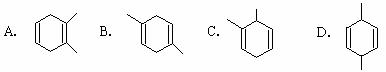
|
A.电解法制铝时一般是用熔融态的氧化铝进行电解但也可用其相应的盐,如熔融态的A1C13
B.电解法生产铝时,需对铝土矿进行提纯,在提纯过程中应用了氧化铝或氢氧化铝的两性
C.在氯碱工业中,电解池中的阴极产生的是H2,NaOH在阳极附近产生
D.氯碱工业和金属钠的冶炼都用到了NaC1,在电解时它们的阴极都是C1-失电子
10.常温下,下列溶液中一定能大量共存的离子组是( )
A.含有大量S2-的溶液:ClO-、Na+、Cl-、CO32-
B.无色澄清溶液:MnO4-、SO42-、K+、Fe3+
C.能使pH试纸变红的溶液:NH4+、Na+、SO42-、Fe3+
D.水电离产生的c(H+)=1×10-12mol/L的溶液:HCO3-、NH4+、Cl-、Ca2+
9.下列说法正确的是( )
A、原子晶体中只存在非极性共价键
B、稀有气体形成的晶体属于分子晶体
C、干冰升华时,分子内共价键会发生断裂
D、金属元素和非金属元素形成的化合物一定是离子化合物
8. 三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程为:用NaOH调NiCl2溶液pH至7.5,加适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是( )
A、可用铁作阳极材料
B、电解过程中阳极附近溶液的pH升高
C、阳极反应方程式为: 2Cl- - 2e- = Cl2
D、1mol二价镍全部转化为三价镍时,外电路中通过了2mol电子。
7. 某种药物主要成分X的分子结构为
,
某种药物主要成分X的分子结构为
,
关于有机物X的说法中,错误的是( )
A.X难溶于水,易溶于有机溶剂 B.X不能跟溴水反应
C.X能使酸性高锰酸钾溶液褪色 D.X的水解产物能发生消去反应
6.下列离子反应方程式正确的是( )
A.澄清石灰水来吸收氯气:Cl2+OH-=Cl-+ClO-+H+
B.将金属Na加入冷水中:2Na+2H2O=2Na++2OH-+H2↑
C.硫酸镁溶液与氢氧化钡溶液反应:SO42─+Ba2+== BaSO4↓
D.在碳酸氢钙溶液中加入少量苛性钾溶液:
Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
4.阿伏加德罗常数约为6.02×1023mol-1,下列说法中一定正确的是( )
A.常温常压下,22g氧气和26g臭氧混合气体所含氧原子总数为3×6.02×1023
B.1L0.5mol/L的CH3COONa溶液中含有的CH3COO-数为0.5×6.02×1023
C.常温常压下,16g 14CH4所含中子数为8×6.02×1023
D.1 mol Cl2发生反应时,转移的电子数一定是2 NA
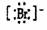 5.下列物质对应的电子式书写正确的是 ( )
5.下列物质对应的电子式书写正确的是 ( )
A.NH4Br:[NH+4] B.CaC12: [Ca2+]
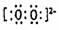
C.N2: D.Na2O2: Na+
Na+
D.Na2O2: Na+
Na+
3. 一定条件下,碘单质与砹单质以等物质的量进行反应,可得AtI。它与Zn、NH3都能发生反应,化学方程式分别如下:2AtI+2Zn==ZnI2+ZnAt2 AtI+2NH3(1)==NH4I+NH2At 。则下列叙述正确的是( )
A.ZnI2既是氧化产物,又是还原产物
B.ZnAt2既是氧化产物,又是还原产物
C.AtI与液氨反应,AtI既是氧化剂又是还原剂
D.AtI与液氨反应,是自身氧化还原反应
2、下列化学式能真实表示物质分子组成的是( )
A.HCOOH B. NaOH C.NH4HCO3 D.Si02
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com