
题目列表(包括答案和解析)
12.下列各组离子在指定条件下一定不能大量共存的是
① 能使红色石蕊试纸变蓝的溶液中:Na+、K+、CO32-、NO3-、AlO2-
② c (H+)=0.lmol·L-1的溶液中:Cu2+、A13+、SO42-、NO3-
③ 能使碘化钾淀粉试纸变蓝的溶液中: Na+、NH4+、S2-、Br-
④ 由水电离出的c(H+)= 10-2mol·L-1的溶液中:Na+、Mg2+、Cl-、HCO3-
⑤ 在加入铝粉能产生氢气的溶液中:NH4+、 Fe2+、SO42-、NO3-
⑥ 在含有大量 Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
A.①②③ B.①③⑥ C.③④⑤⑥ D.②③④⑤
11.用下列装置测定水中氢、氧元素的质量比,其方法是分别测定通入氢气前后硬质玻璃试管的质量差和 U 形管的质量差,实验测得 m ( H ) : m ( O ) > 1 : 8 ,下列对导致这一结果的原因分析中,一定不正确的是
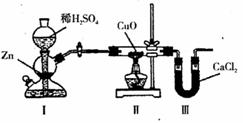
A.I、II 装置之间缺少干燥装置
B.实验后,II 装置中玻璃管内有水冷凝
C.II 装置中 CuO 没有全部被还原
D.III 装置后缺少干燥装置
10.由一种阳离子与两种酸根离子组成的盐称为混盐,混盐 CaOC12 在酸性条件下可以产生 C12 ,下列关于混盐 CaOCl2 的有关判断正确的是
A.该混盐与H2SO4溶液反应产生 l mo1C12 时转移 2 mol 电子
B.该混盐的水溶液呈酸性
C.该混盐具有较强的氧化性
D.该混盐中氯元素的化合价为+l 价
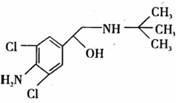
9. 去年,某地区约 300 多人,因食用“瘦肉精”喂养的猪肉而中毒,己知瘦肉精的结构如右图,则它可能发生的化学反应有: ① 酯化反应 ② 取代反应 ③ 氧化反应 ④ 消去反应
A.②④ B.②③
C.①②③ D.①②③④
8. X、Y 为同主族元素,Y 的原子半径大于X。下列说法正确的是(m、n 均为正整数) A.若X(OH)n为强碱,则 Y (OH)n也一定为强碱
B.若 H nXOm 为强酸,则X的氢化物溶于水一定显酸性
 C. 若 H nY为气态,则H n X的熔沸点一定比H nY 低
C. 若 H nY为气态,则H n X的熔沸点一定比H nY 低
D.若Y的最高正价为+7,则X的最高正价一定为+7
7. 神州六号宇宙飞船发射升空,火箭使用的燃料是偏二甲肼[(CH3)2NNH2] ,火箭升空时发生的化学反应为: C2H8N2 + 2N2O4 === 2CO2↑+ 3N2↑ + 4H2O↑ 。下列有关该反应的说法正确的是
A.该反应的氧化剂是偏二甲肼
B.该反应进行时只有放热过程没有吸热过程
C.该反应中氮元素的化合价升高
D.该反应中每生成 l molCO2转移 8 mol 电子
6. 用 NA 表示阿伏加德罗常数的值,下列说法中正确的是
A.1.0L l mol·L-1氨水中 NH3·H2O 的分子数为 NA
B.标准状况下, 11.2 L 氯仿中含有的 C一Cl 键的数目为 1.5NA
C.0.6 g CaCO3 与 KHCO3 的混合物中所含质子数为 0.3NA
D.工业上铜的电解精炼,电解池中每转移 1 mol 电子时阳极上溶解的铜原子数为 0.5NA
29. (13分)将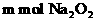 和
和 的混合物在密闭容器中加热至250℃,使其充分反应,混合物中
的混合物在密闭容器中加热至250℃,使其充分反应,混合物中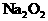 的物质的量分数为X。
的物质的量分数为X。
(1)当X=1/2时,容器中固体产物________________________(写化学式),其物质的量为_______________________________。
(2)若反应后生成的气体为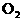 和
和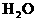 ,则X的取值范围__________________。
,则X的取值范围__________________。
(3)当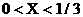 时,产生气体的物质的量n与X的数学表达式
时,产生气体的物质的量n与X的数学表达式
_________________________________________。
28.(16分)钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程中的有关问题。
(1)工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:
____________________________________________ 。
(2)铁在潮湿的空气中容易被腐蚀为铁锈(Fe2O3•x H2O),反应的化学方程式:
____________________________________________ 。
(3)生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,
溶液中发生的化合反应的化学方程式______________________________ 。
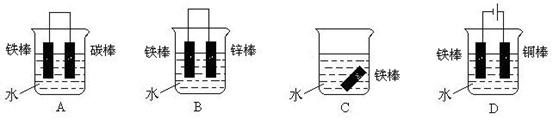
(4)下列哪个装置可防止铁棒被腐蚀_____________ 。
 (5)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下:请回答:
(5)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下:请回答:
① A电极对应的金属是______(写元素名称),B电极的电极反应式是 。
② 若电镀前铁、铜两电极的质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12 g,则电镀时电路中通过的电子为_________mol。
③ 镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因
。
27.(16分)右图是由Emil Zmaczynski设计的金字塔式元素周期表的一部分,图上标有第ⅥA族和几种元素的位置。请回答下列问题:

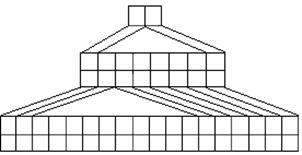
(1)请在上图中将铁元素所在族的位置全部涂黑。
(2)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,理由是:氢的最外层电子“饱和缺一”。请写出NaH的电子式 。
(3)b元素的氢化物与其最高价氧化物的水化物可生成一种盐,该盐溶于水时
(“抑制”、“促进” 或“不影响”)水电离,其反应的离子方程式为:
;土壤中施用该盐做化肥时,其阴离子在水田中的利用率低,说明土壤胶体粒子带 (“正”或“负”)电荷。
(4)下列叙述正确的是 。
A.h的最高价氧化物对应的水化物是一种强碱
B.硒化氢的稳定性强于f的氢化物的稳定性
C.c的氢化物的水溶液是强酸
D.原子半径:h>e>a
E.相同条件下,d与f形成的化合物水溶液的pH大于d与g形成的化合物水溶液的pH,说明相同浓度氢化物水溶液的酸性f弱于g
(5)d的某化合物呈淡黄色,可与氯化亚铁溶液反应生成红褐色沉淀和能使带火星的木条复燃的气体,若沉淀和气体的物质的量之比为2:1,反应的离子方程式为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com