
题目列表(包括答案和解析)
21.(6分)某研究小组拟用定量的方法测量Al和Fe分别与酸反应的快慢,设计了下图1所示的装置。
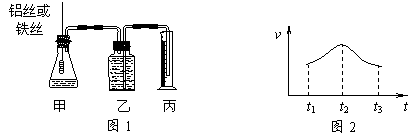
⑴检查图1装置气密性的方法是______________________________________。
⑵若要比较产生气体的快慢,可以测量相同时间内产生气体的体积,也可以测量___________________________________。
⑶实验测得铝丝产生气体的速率(v)与时间(t)的关系如上图2所示,则t1-t2时间内反应速率逐渐加快的主要原因是_______________________________________。
四题(共2小题,23分)
22(11分)、某校高一化学研究性学习小组对日常生活中的氯气用途进行了调查,了解到氯气可广泛地应用于衣物的漂白、水体的杀菌和消毒等。
(1)氯气可以用于漂白、消毒的原因是因为能与水作用形成具有 性的次氯酸,相关反应的离子方程式为 ;
 (2)在调查某室外游泳池夏季池水消毒情况时,小组成员了解到,该游泳池每周一上午8∶00换水,然后通入氯气消毒,通常游泳池水的含氯量控制在0.5 mg/L至1.0mg/L之间时,效果最好。右图是该小组测定的每天19∶00时泳池中水的氯含量,哪几天使用泳池不安全 ;
(2)在调查某室外游泳池夏季池水消毒情况时,小组成员了解到,该游泳池每周一上午8∶00换水,然后通入氯气消毒,通常游泳池水的含氯量控制在0.5 mg/L至1.0mg/L之间时,效果最好。右图是该小组测定的每天19∶00时泳池中水的氯含量,哪几天使用泳池不安全 ;
(3)你认为哪几天的天气炎热、阳光强烈 ,说出一种理由是 ;
(4)在对泳池水中通入氯气消毒时,当发生氯气泄漏时,应立即关闭氯气罐,还应采取下列自救方法 。(选填序号)
A、用湿润的毛巾捂住口鼻跑向低处
B、用浸湿小苏打或肥皂水的毛巾捂住口鼻跑向高处
C、用浸湿浓氨水的毛巾捂住口鼻匍匐跑至安全处
D、用浸湿食盐水的毛巾捂住口鼻顺风跑至安全处
(5)小型泳池通常使用漂白液(NaClO溶液)而非氯气来消毒池水,试举出使用漂白液而非氯气的一项理由 ;
(6)请再写出你能知道的能用于饮用水消毒的消毒剂(至少写三种,否则不得分)
请在你书写的药品中选择一种你认为最好的带上飞机,并说明它的原因。
选择 原因
20、(6分)某学生为了使过滤操作能自动添加液体,设计
了“自动加液过滤器”,如图所示。在倒置的烧瓶中盛放
待过滤的液体,液体从“液体流出管”流入漏斗。为使液
体顺利流下,还需插入“空气导入管”与大气相通。
(1)“空气导入管”下口应在____ ,上口应在_______ 。
A.滤纸边沿下方 B.滤纸边沿上方
C.待过滤液液面上 D.待过滤液中
E.A和B项均可 F.C和D项均可
(2)试简要说明自动加液过滤的原理。
__________________________________________________
19.某学生用NaHCO3,和KHCO3,组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等)
|
|
50mL 盐酸 |
50mL 盐酸 |
50mL 盐酸 |
|
m(混合物) |
9.2g |
15.7g |
27.6g |
|
V(CO2)(标况) |
2.24L |
3.36L |
3.36L |
则下列分析推理中不正确的是
A.盐酸的物质的量浓度为3.0mol·L
B.根据表中数据不能计算出混合物中NaHCO3的质量分数
 C.加入混合物9.2g时盐酸过量
C.加入混合物9.2g时盐酸过量
D.15.7g混合物恰好与盐酸完全反应
|
三题(共2小题,12分)
18.有10 g不纯CaCO3样品与足量盐酸作用后生成4.44 g CO2,且溶液中残留难溶物质。则对于此样品中是否存在①MgCO3 ②K2CO3 ③SiO2杂质的判断正确的是( )
A.肯定含①③,不含② B.肯定含①③,可能含②
C.肯定含②③,不含① D.肯定含②③,可能含①
17.t℃时CuSO4的溶解度是S g,其饱和溶液密度d g.cm-3、物质的量浓度为c mol.L-1。向足量饱和溶液中加入m g无水CuSO4或蒸发掉n g水后恢复t℃,均能获得W g胆矾晶体,下列关系式正确的是( )
A.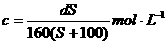 B.
B.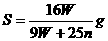
C.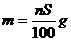 D.
D.
16.已知酸性条件下有如下反应:2Cu+=Cu2++Cu。由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或Cu2O,两者都是红色固体。一同学对某次用氢气还原氧化铜实验所得的红色固体产物作了验证,实验操作和实验现象记录如下 ( )
|
加入试剂 |
稀硫酸 |
浓硫酸、加热 |
稀硝酸 |
浓硝酸 |
|
实验现象 |
红色固体 和蓝色溶液 |
无色气体 |
无色气体 和蓝色溶液 |
红棕色气体 和绿色溶液 |
由此推出本次氢气还原氧化铜实验的产物是
A.Cu B.Cu2O
C.一定有Cu,可能有Cu2O D.一定有Cu2O,可能有Cu
15.实验室需配制一种仅含四种离子(不包括水电离出的离子)的无色混合溶液,且在混合溶液中四种离子的物质的量浓度均为lmol·L-1。下面四个选项中能达到此目的的是
A.NH4+、Na+、NO3-、Cl- B.Cu2+、K+、SO42-、NO3-
C.H+、K+、HCO3-、Cl- D.Mg2+、Na+、Cl-、SO42-
14.用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.0.36 g水中所含中子数一定为0.2 NA
B.4.48 L N2与CO的混合物所含分子数一定为0.2 NA
C.6.4 gS6与S8的混合物中所含S原子数一定为0.2 NA
D.标准状况下,2.24 L氧气所含原子数一定为0.2 NA
13.某同学用一小块铝片和盐酸反应制取H2,实验现象如下表:
|
时间 |
1 min |
2 min |
5 min |
15 min |
20 min |
|
现象 |
少量气泡 |
较多气泡 |
大量气泡 |
反应剧烈 |
铝片耗尽 |
反应1-15min内,铝与盐酸的反应速率变化的可能原因是 ( )
A.该反应是放热反应,温度升高 B.反应过程中盐酸的浓度增大
C.随着反应的进行,铝片表面积变小 D.Cl-离子是该反应的催化剂
12.下列离子方程式,正确的是 ( ) A.在溶液中亚硫酸氢铵与等物质的量氢氧化钠混合
 B.碳酸钠溶液中加入二氧化硅:CO32- +SiO2==SiO32- +CO2↑
C.二氧化硅与烧碱溶液反应:SiO2 +2OH- === SiO32-+H2O
D.硅酸与烧碱溶液中和:H2SiO3 +2OH- === SiO32-+2H2O
B.碳酸钠溶液中加入二氧化硅:CO32- +SiO2==SiO32- +CO2↑
C.二氧化硅与烧碱溶液反应:SiO2 +2OH- === SiO32-+H2O
D.硅酸与烧碱溶液中和:H2SiO3 +2OH- === SiO32-+2H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com