
题目列表(包括答案和解析)
2.下列叙述正确的是
A 日常生活中无水乙醇常用于杀菌消毒
B 明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同
C目前加碘食盐中主要添加的KIO3
D在PH=1的含有Mg2+、Fe2+、Al3+三种阳离子的溶液中,可能存在阴离子Cl- \NO3- \SO42-
1、许多国家十分重视海水资源的综合利用。不需要化学变化就能够从海水中获得的物质是
A、氯、溴、碘 B、钠、镁、铝
C、烧碱、氢气 D、食盐、淡水
23.(12分)氨气极易溶于水,人们把氨气溶于水后得到的 溶液称为氨水。
(1)将标准状况下11.2 L氨气溶于100 mL水中,得到密度为0.868 g/cm3的氨水。求所得氨水的物质的量浓度。
(2)将上述30 mL氨水与70 ml 2 mol/L的A1C13溶液混合,生成的沉淀质量为n g,求n值。(3)若往上述(2)反应后未过滤的浊液中加入y mL 5 mol/L的NaOH溶液后,仍得到沉淀物的质量为n g,求所加氢氧化钠溶液的最大体积。
22. (8分) 6.4克铜与过量硝酸(a mol/L ,30mL)充分反应,硝酸的还原产物只有NO2、NO,反应后溶液中含H+为0.1mol。
(1)此时溶液中所含NO3-为 mol
(2)求生成的气体中NO2和NO的物质的量各为多少(用含有a的式子表示)
21.(6分)已知4ºC时四种化合物在水中和液氨中的溶解度如下:
 溶
溶 溶
溶解 质  度 度溶 剂 |
AgNO3 |
Ba(NO3)2 |
AgCl |
BaCl2 |
|
H2O(液) |
170g |
9.2g |
1.5×10-4g |
33.3g |
|
NH3(液) |
86g |
97.2g |
0.8g |
0g |
上述四种物质在液氨溶液中发生复分解反应的化学方程为________________________
在水中发生复分解反应的离子方程式为_______________________________________。
20.(13分)根据下列框图关系填空,已知反应①、③是我国工业生产中的重要反应,X常温下为无色无味透明液体;C焰色反应火焰呈黄色,J为红褐色沉淀;D、E常温下为气体,且E能使品红溶液褪色;A固体中仅含两种元素,其中金属元素的质量分数约为46.7%。
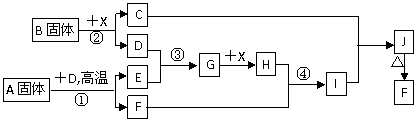
(1)G的化学式为 ;
(2)固体A中所包含的化学键与固体B类似,则A的电子式为 ;
(3)反应②的离子方程式: ;
(4)反应④的离子方程式: ;
(5)已知每生成16 g E,放出106.5 kJ热量,则反应①的热化学方程式为:
。
19.(17分)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:NH3+CO2+H2O NH4HCO3 ; NH4HCO3+NaCl NaHCO3↓+NH4Cl ;
 2NaHCO3 Na2CO3+CO2↑+H2O
2NaHCO3 Na2CO3+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填字母标号)。
a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
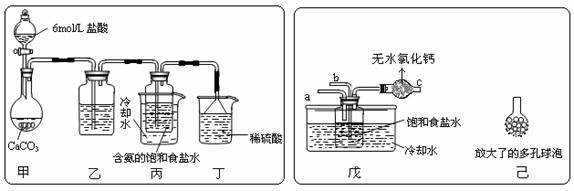
试回答下列有关问题:
 (Ⅰ)乙装置中的试剂是 ;
(Ⅰ)乙装置中的试剂是 ;
(Ⅱ)丁装置中稀硫酸的作用是 ;
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是 (填分离操作的名称)。
② 另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从 管通入 气体,再从 管中通入 气体;
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是 ;
(3)请你再写出一种实验室制取少量碳酸氢钠的方法: 。
18. a mol FeS与b mol FeO投入到V L、c mol•L-1的硝酸中恰好反应,产生NO气体,所得澄清溶液是Fe(NO3)3、H2SO4的混合液,反应中被还原的硝酸可能为
a mol FeS与b mol FeO投入到V L、c mol•L-1的硝酸中恰好反应,产生NO气体,所得澄清溶液是Fe(NO3)3、H2SO4的混合液,反应中被还原的硝酸可能为
A.(a+b)×63g B.(a+b)mol C.( )mol
D.(V×c-3a-3b)×63g
)mol
D.(V×c-3a-3b)×63g
卷II(58分)
17.如右图所示,a、b是多孔石墨电极,某同学按图示装置进行如下 实验:断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转。下列说法不正确的是
A.断开K2,闭合K1一段时间,溶液的pH要变大
B.断开K1,闭合K2时,b极上的电极反应式为:
2H++2e-=== H2↑
C.断开K2,闭合K1时,a极上的电极反应式为:
4OH-―4e-=== O2↑十2H2O
D.断开K1,闭合K2时,OH-向b极移动
16.用固体NaOH配制物质的量浓度溶液时,下列操作会导致溶液浓度偏高的是
A.在烧杯中溶解时,有少量液体溅出
B.定容后,轻轻振荡、摇匀、静置,液面下降再加水至刻度
C.容量瓶使用前未干燥 D.定容时俯视容量瓶刻度线
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com