
题目列表(包括答案和解析)
3.右图中每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化(外压为1atm),其中▲代表的是
A.AsH3 B.HBr C.H2Se D.GeH4
2. 不能用勒沙特列原理解释的是
不能用勒沙特列原理解释的是
A.经粉碎的黄铁矿在沸腾炉中燃烧得较快、较完全
B.饱和FeCl3溶液中加入盐酸,丁达尔效应减弱
C.NaOH溶液使酯水解比稀H2SO4使酯水解效果好
D.氨水的保存需要密封、低温保存
1.设NA表示阿佛加德罗常数的值,下列关于NA的下列说法中正确的是
A.铁粉与一定量浓硫酸反应,产生11.2LSO2和1gH2,铁粉失去的电子数为2NA
B.124g白磷中含有P-P键的数目为4NA
C.含2NA个化学键的CnH2n+2分子的物质的量为2/(3n+1)mol
D.7.8gNa2S溶于水中,S2-的数目为0.1NA
27.把由NaOH,AlCl3,MgCl2三种固体组成的混合物溶于足量水中后有0.58 g白色沉淀。在所得浊液中逐滴加入0.5 mol/L盐酸,加入盐酸的体积与生成沉淀的质量关系如右图所示:
计算:①混合物中NaOH质量是多少克?
②P点所表示的盐酸的体积是多少毫升?
26.已知固体甲、E、I、F均为常见的单质,其中E在常温下为无色气体。W是由两种短周期元素组成,且两元素的原子个数比为4∶3。乙通常是一种红棕色粉末。G为白色胶状沉淀。W、G、H、I四种物质中都含有同一种的短周期金属元素。A在常温下为气态,与氧气完全反应时的体积比是1∶2。各物质有如下图所示的转化关系(部分反应的产物未全部表示)。试回答下列问题:
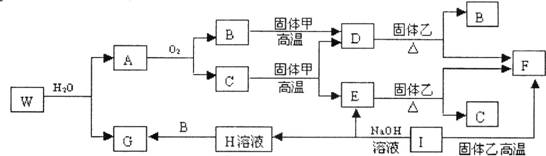
(1)W的化学式为 ,B的电子式为 ;
(2)在上述转化关系图中,C→E、D→F、E→F、I→F、I→E、A→B等反应中有多个反应属于置换反应,根据要求写出化学方程式。
非金属元素之间的置换反应 ;
金属元素之间的置换反应 ;
(3)在I→E反应中,每生成1mol E,转移电子数为 。
25.工业上制纯碱是根据NaHCO3溶解度比NaCl、Na2CO3、NH4Cl、NH4HCO3都小的性质,在适宜温度下运用:CO2+NH3+H2O+NaCl→NaHCO3+NH4Cl等反应原理制取的。欲在实验室通过上述过程和其它的必要反应制取纯碱,可用下列图示中的①②③④几个步骤,其中A、B分别代表CO2和NH3之一。

(1)操作③所得到的晶体是下列的____;
A.NH4Cl B.NaHCO3 C.Na2CO3 D.NH4HCO3
(2)对于上述过程,下列叙述正确的是 。
A.气体A是CO2,气体B是NH3
B.气体A是NH3,气体B是CO2
C.步骤④是加热
D.①②两步操作的顺序与两种气体溶解度有重要的关系,不能颠倒
24.把27 g Al粉和一定量的Fe3O4粉混合均匀,配成铝热剂,分成两等份。
(1)前一份在高温下恰好完全反应,且能放出207.54kJ热量,写出此反应的热化学方程式 。
(2)将前一份所得的生成物与足量的盐酸充分反应;后一份直接加入足量的氢氧化钠溶液使之充分反应。前后两种情况下生成气体的物质的量之比为 。
23.现有Al3+、Ba2+、Mg2+、Ag+四种离子的混合溶液,若要使这四种离子依次成为沉淀从溶液中分离出来(可供选择的粒子为H+、OH-、NH4+、Cl-、NO3-、SO42-、CO32-及CO2),则应加入的粒子的最佳选择及顺序依次为 。
22.(1)由Al3+制Al(OH)3最好的方法是加入 ,写出反应的离子方程式 。
(2)由AlO2-制Al(OH)3最好的方法是通入 ,写出反应的离子方程式 。
21.(1)48 g RO42- 中,核外电子总数比质子总数多 6.02×1023 个,则R元素的摩尔质量为 。
(2)有一真空瓶的质量为M1 g ,该瓶充入空气后总质量为M2 g;在相同状况下,若改充某气体A后,总质量为M3 g,则A的相对分子质量为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com