
题目列表(包括答案和解析)
24.(12分)用石墨电极电解200mL0.5mol/L的NaCl溶液,阳极收集到2.24L(标准状况)气体时,停止通电。请回答以下问题:
(1)电解过程中阳极的电极反应分别为 、 ;
(2)阴极生成的气体体积为 L(标准状况);
(3)若将阳极生成的气体通入电解后的溶液中,充分反应后,则所得溶液中离子的浓度由大到小依次是 ;
(4)常温下,若将电解后的稀溶液稀释至1L,则溶液的pH约为 ;
(5)若将电解后阳极所产生的气体全部通入1mol/L500mLNa2SO3的溶液中,使之充分反应(假设溶液的体积变化忽略不计),则所得溶液中SO42-的物质的量浓度最多为 mol/L。
参考答案及评分标准
23.(7分)将1 mol I2(g)和2mol H2(g)置于某2L密闭容器中,在一定温度下发生反应:I2(g) + H2(g)  2HI(g);
2HI(g); <0,并达到平衡。HI的体积分数Φ(HI)随时间变化如图中曲线(Ⅱ)所示:
<0,并达到平衡。HI的体积分数Φ(HI)随时间变化如图中曲线(Ⅱ)所示:
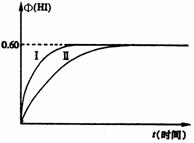 (1)达平衡时,I2(g)的物质的量浓度为______mol · L – 1。
(1)达平衡时,I2(g)的物质的量浓度为______mol · L – 1。
(2)若改变反应条件,在某条件下Φ(HI)的变化如曲线(I)所示,则该条件可能是________(填入下列条件的序号)。
①恒容条件下,升高温度
②恒容条件下,降低温度
③恒温条件下,缩小反应容器体积
④恒温条件下,扩大反应容器体积
⑤恒温、恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2L密闭容器中加入a mol I2(g)、b mol H2(g)和c mol HI(g)(a、b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.60,则a、b、c应满足的关系为_________________(用一个含a、b、c的代数式表示)。
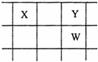
22.(11分)核电荷数由小到大顺序排列的五种短周期元素X、Y、Z、W、Q。其中:在同周期元素中,Z的金属性最强,Q的非金属性最强;W的单质是淡黄色固体;X、Y、W在周期表中的相对位置关系如图所示:
|
(2)这五种元素中,原子半径最大的是 (填化学式);由Z、W、Q形成的简单离子半径由大到小的顺序是 (用化学式表示);X、W、Q的最高价氧化物的水化物酸性从强到弱的顺序为 (用化学式表示);
(3)Y和Z形成的一种化合物中含有离子键和共价键,写出该化合物与水反应的化学方程式 ;
(4)写出由W所在主族元素形成的含有18e-的四原子氢化物的电子式 ;
(5)由X、Y和氢三种元素组成的化合物X6H12Y6,已知:9g该化合物燃烧生成XY2和液态H2Y时,放出140kJ的热。写出该化合物燃烧热的热化学方程式:
。
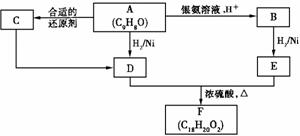
21.(14分)有机物A能发生如下图所示的变化。其中,C能使溴的四氯化碳溶液褪色,D不含甲基,在一定条件下能发生消去反应。
填写下列空白:
(1)A分子中的含氧官能团的名称为 ,C的结构简式是 。
(2)C→D的反应类型是 (填标号)。
a.氧化反应 b.还原反应 c.加成反应 d.取代反应
(3)D+E→F的化学方程式是 。
(4)与D分子式相同,其中能与金属钠反应且苯环上有一个取代基(包括D)的同分异构体有 种。
(5)A-F六种化合物中能与金属钠反应,但不能与氢氧化钠反应的是 (填标号,下同);燃烧时消耗的氧气和生成的CO2、H2O之间物质的量之比为11:9:5的是 。
19.(11分)分别取40mL的0.50mol/L盐酸与0.55mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题。
(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式 ;
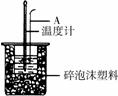 (2)如右图所示,仪器A的名称是_______________;在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的
(2)如右图所示,仪器A的名称是_______________;在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的 (填“偏大”、“偏小”或“无影响”);
(填“偏大”、“偏小”或“无影响”);
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g·℃)。为了计算中和热,实验时还需测量的数据有(填序号)__________;
A.反应前盐酸溶液的温度 B.反应前盐酸溶液的质量
C.反应前氢氧化钠溶液的温度 D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度 F.反应后混合溶液的质量
(4)某学生实验记录数据如下:
|
实验序号 |
起始温度t1℃ |
终止温度t2℃ |
|
|
盐酸 |
氢氧化钠 |
混合溶液 |
|
|
1 |
20.0 |
20.1 |
23.2 |
|
2 |
20.2 |
20.4 |
23.4 |
|
3 |
20.5 |
20.6 |
23.6 |
依据该学生的实验数据计算,该实验测得的中和热 =____________________;
=____________________;
(5) (填“能”或“不能”)用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,理由是 。
|
|
|
4CuO======2Cu2O+O2 2SO3 2SO2 + O2
取一定量硫酸铜晶体(CuSO4·XH2O)置于已知质量的坩埚中称重,测得硫酸铜晶体的质量为ag。用酒精灯将坩埚充分加热,然后放入干燥器中冷却,再称重。经若干次加热、
班级 姓名 学号
冷却称重,直到质量基本不变,称得坩埚中剩余固体物质的质量为bg。
(1)在上述实验操作中,至少称量 次。
(2)该晶体中x的实验值为________________________________________。
(3)将实验值与根据化学式(CuSO4·5H2O)计算的结果比较,实验值大于计算值,造成误差的原因可能是____________________。
a.实验中部分固体溅出 b.加热温度过高
c.部分样品已风化 d.硫酸铜晶体中含有不挥发性杂质
(4)另取25.0g胆矾(CuSO4·5H2O),缓慢升温到1000℃,
①在加热过程中,当固体物质的质量为10.0g时,该固体可能的组成是(用化学式表示)___________________________。
②在1000℃时,除水外,其余气态产物物质的量(n)的取值范围是(不考虑实 验误差)___________________________________________。
18.运用元素周期律分析下面的推断,其中错误的是:①铍(Be)的最高价氧化物的水化物可能具有两性;②铊(Tl)既能与盐酸作用产生氢气,又能跟NaOH溶液反应放出氢气,Tl(NO3)3溶液的酸性很强;③砹(At)为有色固体,HAt不稳定,AgAt感光性很强,但不溶于水也不溶于稀酸;④锂(Li)在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱;⑤硫酸锶(SrSO4)是难溶于水的白色固体;⑥硒化氢(H2Se)是无色,有毒,比H2S稳定的气体。
A.①②③④ B.②④⑤ C.①③⑤ D.②④⑥
班级 姓名 学号 成绩
请将Ⅰ卷的答案填入下表中
第Ⅱ卷(非选择题,共64分)
17.t℃时,NaCl的溶解度为ag,取该温度下的饱和氯化钠溶液VmL,测得其密度为ρg/cm3,则下列表达式正确的是
A.w (NaCl)=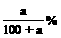 B.n (NaCl)=
B.n (NaCl)=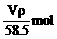
C.n (NaCl)=
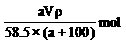 D.c (NaCl)=
D.c (NaCl)=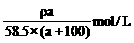
16.两个体积相同的密闭容器A和B,在A中充入SO2和O2各1g,在B中充入SO2和O2各2g,加热到相同温度,发生如下反应:2SO2(气)+O2(气)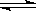 2SO3(气),对此反应的下列说法不正确的是
2SO3(气),对此反应的下列说法不正确的是
A.反应速率:B>A B.SO2的转化率B>A
C.平衡时各组分含量:B=A D.平衡时容器内压强B>A
15.镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳,越来越成为人们研制绿色原电池的关注焦点。其中一种镁原电池的反应为:
 MgxMo3S4
x Mg + Mo3S4
MgxMo3S4
x Mg + Mo3S4
在镁原电池放电时,下列说法错误的是
A.Mg2+向正极迁移 B.正极反应为:Mo3S4 + 2xe- = Mo3S42x-
C.Mo3S4发生氧化反应 D.负极反应为:xMg-2xe- = xMg2+
14.利尿剂是2008北京奥运会违禁药物,顾名思义,此类药物有稀释尿液的功能。利尿剂现有15种,主要用于掩盖或“清洗”体内其它违禁药品的存在,以逃避兴奋剂检查。下图所示有机物是其中之一的结构简式:
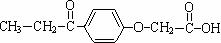
下列叙述正确的是
A.1mol利尿酸最多可与5mol H2发生加成反应
B.利尿酸分子式是C11H12O4
C.利尿酸分子中位于同一平面内的原子有10个
D.利尿酸与新制Cu(OH)2悬浊液反应有红色沉淀生成
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com