
题目列表(包括答案和解析)
5.下列有关物质类别判别的依据正确的是 ( )
A.原子晶体:晶体的熔点是否很高 B.电解质:水溶液是否导电
C.离子化合物:是否含有离子键 D.共价化合物:是否含有共价键
4.下列有关物质分类的说法正确的是 ( )
A.O2和O3、H2和D2、H O和H
O和H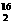 O都互为同素异形体
O都互为同素异形体
B.纯碱、烧碱、碱式碳酸铜都属于碱类物质
C.煤、石油和天然气都属于化石能源
D.CH2Cl2、CH4O、C2H4O2一定是纯净物
3.下列化学用语表达正确的是 ( )
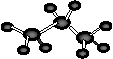 A.丙烷的分子结构模型示意图:
A.丙烷的分子结构模型示意图:
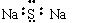
B.Na2S的电子式:
C.丙烯的结构简式:CH3CH2CH2
D.氢硫酸的电离方程式:H2S+H2O=H3O++HS-
2.已知“凡气体分子总数增多的反应一定是熵增大的反应”。一定条件下,下列反应不可能自发进行的是 ( )
A.2O3(g)=3O2(g) △H<0
B.2CO(g)=2C(s)+O2(g) △H>0
C.N2(g)+3H2(g)=2NH3(g) △H<0
D.CaCO3(s)=CaO(s)+CO2(g) △H>0
1.气体分子中的极性键在红外线的照射下,易像弹簧一样作伸缩和弯曲运动,从而产生热量。下列气体不属于温室效应气体的是 ( )
A.CO2 B.N2O C.CH4 D.N2
23.(8分)现有一种碱金属的碳酸盐(M2CO3)和碳酸氢钠组成的混合物,取其1.896g加热至质量不再变化,把放出的气体通入足量的澄清石灰水中,得到白色沉淀0.800g。将加热后残留的固体与足量稀硫酸充分反应,生成的气体经充分干燥后通过足量的过氧化钠粉末(反应为:2Na2O2+2CO2=2Na2CO3+O2),结果过氧化钠粉末增重0.336g。
⑴通过计算确定M2CO3的M为何种元素。
⑵有同学提出,通过简单的定性实验,也可以确定该样品中的M为何种碱金属元素。你认为该实验方案是什么?
22.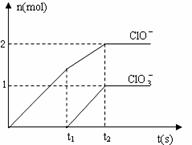 (8分)在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如右图所示。
(8分)在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如右图所示。
⑴t2时,Ca(OH)2与Cl2发生反应的总的化学方程式为_____________________________________________。
⑵该石灰乳中含有Ca(OH)2的物质的量是_______ mol。
⑶ 据分析,生成Ca(C1O3)2的反应是由温度升高引起的,通入氯气的速度不同,C1O-和C1O3-的比例也不同。
若在原石灰乳中通入氯气的速度加快,则反应后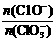 2(填“>”、“<”或“=”);
2(填“>”、“<”或“=”);
若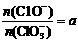 ,则n(C1-)= mol(用含a的代数式来表示)。
,则n(C1-)= mol(用含a的代数式来表示)。
21. (12分)2007年诺贝尔化学奖授予德国科学家格哈德·埃特尔,以表彰他在表面化学研究领域作出的开拓性贡献。
(12分)2007年诺贝尔化学奖授予德国科学家格哈德·埃特尔,以表彰他在表面化学研究领域作出的开拓性贡献。
⑴某校化学研究性学习小组的同学在技术人员的指导下,按下列流程探究不同催化剂对NH3还原NO反应的催化性能。
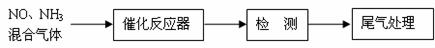
若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体通过滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。为比较不同催化剂的催化性能,需要测量并记录的数据是 。
⑵在汽车的排气管上安装“催化转化器”(用铂、钯合金作催化剂),它的作用是使CO、NO反应生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧。
①写出CO与NO反应的化学方程式: ,该反应作氧化剂的物质是_________。
②用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g); ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g); ΔH2
若1mol CH4还原NO2至N2,整个过程中放出的热量为867kJ,则ΔH2= 。
⑶①有人认为:该研究可以使氨的合成反应,在铁催化剂表面进行时的效率大大提高,从而使原料的转化率大大提高。请你应用化学基本理论对此观点进行评价: 。
②合成氨工业生产中所用的α-Fe催化剂的主要成分是FeO、Fe2O3,当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化活性最高,以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:2 Fe2O3十C
 4FeO十CO2↑。为制得这种活性最高的催化剂,应向480g Fe2O3粉末中加入炭粉的质量为
g。
4FeO十CO2↑。为制得这种活性最高的催化剂,应向480g Fe2O3粉末中加入炭粉的质量为
g。
20.(12分)下图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去)。
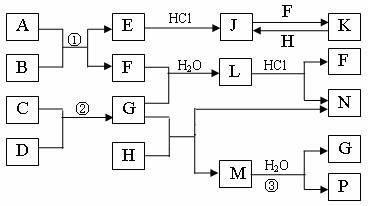
已知:E为红色固体,K为浅绿色溶液;反应②是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H常温下是气态; F、P 和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G分子构型为三角锥形,化合物M由两种元素组成,分子内共有58个电子。
⑴化合物A中含有的两种元素是 。
⑵F的化学式 ;G的水溶液中,最多的阳离子是 。
⑶写出K与H反应的离子方程式: ;
G与H反应的化学方程式: 。
⑷在实验室中,向饱和H水溶液中加入CaCO3粉末,充分反应后过滤,可制得浓度较大的P的水溶液。使用化学平衡移动原理加以解释
。
19.(10分)在一固定体积的密闭容器中,在850℃时发生如下反应:
CO(g)+H2O(g) CO2(g)+H2(g); △H=-41.2kJ/mol。容器内各物质的浓度(mol/L)变化如下(在850℃其化学平衡常数K=1.0)。
CO2(g)+H2(g); △H=-41.2kJ/mol。容器内各物质的浓度(mol/L)变化如下(在850℃其化学平衡常数K=1.0)。
|
时间/min |
CO |
H2O |
CO2 |
H2 |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
c1 |
c2 |
c3 |
c3 |
|
4 |
c1 |
c2 |
c3 |
c3 |
⑴下列可以作为判断该反应已经达到化学平衡状态依据的是 。
a.容器内压强不变 b.v正(H2) = v逆(CO)
c.混合气体中CO2的浓度不变 d.c(CO2) = c(CO)
⑵若在850℃时向反应容器中充入H2O(g),K值 (填“增大”、“减小”或“不变”,下同);若升高反应体系的温度,K值 。
⑶上表中:c1 = mol/L,H2O (g)的转化率为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com