
题目列表(包括答案和解析)
1.0 mol/LHCl溶液的滴定曲线
B.在pH为6.37及10.25时,溶液中
c(H2CO3)=
c(HCO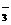 )= c(CO
)= c(CO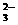 )
)
C.人体血液的pH约为7.4,则CO2在
血液中多以HCO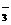 的形式存在
的形式存在
D.若用CO2和NaOH反应制取Na2CO3,溶液的pH必须控制在12以上
15.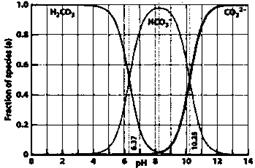 下图是一水溶液在pH从0至14的范围内,
下图是一水溶液在pH从0至14的范围内,
H2CO3、HCO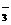 、CO
、CO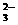 三种成分平衡时的
三种成分平衡时的
组成百分率,下列叙述正确的是( )
A.此图是1.0mol/L碳酸钠溶液滴定
14.下列溶液中各微粒的浓度关系正确的是 ( )
A.物质的量浓度相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中c(NH4+):
c[(NH4)2SO4] > c(NH4HSO4) > c(NH4Cl)
B.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:
c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.某二元弱酸的酸式盐NaHA溶液中:
c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-)
D.1.0mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
13.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其与水的离子反应是:
4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-。工业上先制得Na2FeO4,然后在低温下,向Na2FeO4溶液中加入一定量KOH,可制得K2FeO4。下列说法中不正确的是 ( )
A.K2FeO4溶液有丁达尔效应
B.K2FeO4溶液具有吸附性
C.K2FeO4溶液能除去氧化性杂质
D.上述制得K2FeO4的反应为复分解反应
12.下列有关化学事实或现象的解释正确的是 ( )
A.合金在潮湿的空气中形成原电池,故其耐腐蚀性都较差
B.氯化钠溶于水也有化学过程,是因为离子键发生了断裂
C.升高温度反应速率加快,原因是活化分子百分数增加
D.铝的金属性较强,所以铝制容器在空气中容易被腐蚀
11.下列离子方程式书写正确的是 ( )
A.用氨水溶解氯化银沉淀:Ag++2 NH3·H2O=[Ag(NH3)2]++2 H2O
B.向Ba(OH)2溶液中滴加NH4HSO4溶液至刚好沉淀完全:
Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3·H2O+ H2O
C.硫酸亚铁溶液与稀硫酸、双氧水混合:2Fe2++H2O2 +2H+=2Fe3++2H2O
D.向次氯酸钠溶液中通入足量SO2气体:ClO-+ SO2+ H2O = HClO+ HSO3-
9.阿伏加德罗常数约为6.02×1023mol-1。下列叙述中正确的是 ( )
A.32g含有少量臭氧的氧气中,共含有氧原子1.204×1024
B.在标准状况下,2.24L己烷中所分子数约为6.02×1023
C.12.5 mL 16 mol/L浓硫酸与足量铜反应,生成SO2的分子数约为6.02×1022
D.2.7g铝与足量氢氧化钠溶液反应转移的电子数约为1.806×1023
|
A.pH=1的溶液中:Fe2+、Al3+、HCO3-、MnO4-
B.能与金属铝反应放出氢气的溶液:K+、NO3-、Cl-、NH4+
C.含有大量OH-的无色溶液中:Na+、Cu2+、AlO2-、SiO32-
D.常温下水电离出的c(H+)·c(OH-)=10-20的溶液中:Na+、C1-、S2-、SO32-
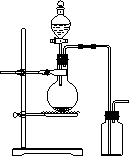
8.可用右图装置制取(必要时可加热)和收集的气体是( )
A.氯酸钾溶液与二氧化锰反应制氧气
B.浓氨水与氢氧化钙固体制氨气
C.乙醇和浓硫酸(170℃)制乙烯
D.铜和浓硝酸制二氧化氮
7. 下列大小或强弱比较正确的是( )
下列大小或强弱比较正确的是( )
A.原子半径:Cl>S
B.稳定性:HCl>HBr
C.酸性:H2SiO3>H2CO3
D.碱性:Al(OH)3>Mg(OH)2
6.下列过程或现象与盐类水解无关的是 ( )
A.加入硫酸铜溶液加快制氢气的速度
B.硫酸铝溶液不能置于铁质容器中
C.用热的纯碱溶液去除油污
D.浓硫化钠溶液有硫化氢的气味
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com