
题目列表(包括答案和解析)
22、(10分)钾是活泼的碱金属,钾和氧有氧化钾(K2O)、过氧化钾(K2O2)和超氧化钾(KO2)等多种化合物。
(1)钾和硝酸钾反应可制得K2O(10K+2KNO3=6K2O+N2↑),39.0g钾与10.1g硝酸钾充分反应生成K2O的质量为 g。
(2)某过氧化钾样品中氧的质量分数(杂质不含氧)为0.28,则样品中K2O2的质量分数为 。
(3)超氧化钾和二氧化碳反应生成氧气(4KO2+2CO2=2K2CO3+3O2),在医院、矿井、潜水、高空飞行中用作供氧剂。13.2L(标准状况)CO2和KO2反应后,气体体积变为18.8L (标准状况),计算反应消耗的KO2的质量。
(4)KO2加热至600℃部分分解得到产物A。6.30g产物A充分吸收二氧化碳生成碳酸钾并产生氧气1.12L(标准状况),试确定产物A中钾氧两种原子个数之比。如果产物A只含有两种化合物,写出所有可能的化学式并计算A中两种化合物的物质的量之比。
21、(6分)一定量的氢气在氯气中燃烧,所得混合物用100mL 3.00mol/L的NaOH溶液(密度为1.12g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。
(1)原NaOH溶液的质量分数为
(2)所得溶液中Cl-的物质的量为 mol
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2)∶n(H2)= 。
20、(9分)有机物A为茉莉香型香料。
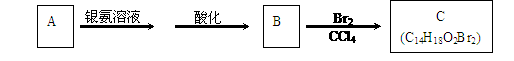
(1)A分子中含氧官能团的的名称是 。
(2)C的分子结构可表示为(其中R和Rノ的代表不同的烃基)
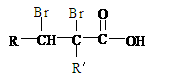
A的化学式是 ,A可以发生的反应是 (填写序号字母)。
a.还原反应 b.消去反应 c.酯化反应 d.水解反应
(3)已知含有烃基R的有机物R-OH与浓溴水反应产生白色沉淀,则含有烃基R′的有机物
R′-OH为类别属于 。
(4)A分子结构中只有一个甲基,A的结构简式是 。
(5)在浓硫酸存在下,B与乙醇共热生成化合物C16H22O2的化学方程式是
。
(6)在A的多种同分异构体中,分子结构中除烃基R′含有三个甲基外,其余部分均与A相同的有 种。
19、(7分)已知有机物A是具有果香味的液体,其分子式是C4H8O2,在一定条件下有下列转化关系:
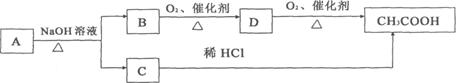
(1)写出A、B、C的结构简式:
A ,B ,C 。
(2)写出下列反应的化学方程式:
①A →B+C: ;
②D与新制的Cu(OH)2悬浊液共热: 。
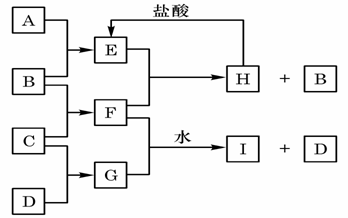
18、(8分)A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1∶2。在一定条件下,各物质之间的相互转化关系如下(图中部分产物未列出):
请填写下列空白:
(1)A是 ,C是 。(填名称)
(2)H与盐酸反应生成E的化学方程式是 。
(3)E与F反应的化学方程式是 。
(4)F与G的水溶液反应生成I和D的离子方程式是 。
17、(10分)如图装置,A、B中的电极为多孔的惰性电极;C、D为夹在湿的Na2SO4滤纸条上的铂夹;电源有a、b两极.若A、B中充满KOH溶液后倒立于KOH溶液的水槽中.切断K1,合闭K2、K3通直流电,回答下列问题:

(1)判断电源的正、负极:a为________极,b为________极。
(2)在湿的Na2SO4溶液滤纸条中心的KMnO4液滴,有什么现象
。
(3)写出电极反应式:A极 ,C极 。
(4)若电解一段时间后,A、B中均有气体包围电极。此时切断K2、K3,合闭K1,则电流表的指针是否移动(填是或否) ______________。说明理由_________________________
__________________________________________________________________________。
16、(10分)海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
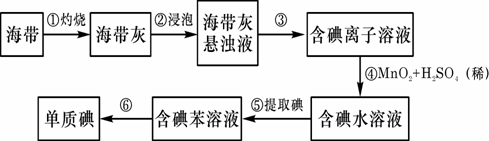
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是 (从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是 ;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 。
(3)步骤④反应的离子方程式是 。
(4)步骤⑤中,某学生选择用苯来提取碘的理由是 。
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法: 。
15、(10分)根据实验室中测定硫酸铜晶体结晶水含量的实验,填写下列空白:
(1)从下列仪器中选出所需仪器(用标号字母填写) 。
A.托盘天平(带砝码) B.研钵 C.试管夹 D.酒精灯 E.蒸发皿 F.玻璃棒 G.坩埚
H.干燥器 I.石棉网 J.三脚架
除上述仪器外,还需要的仪器是 。
(2)某学生实验后得到以下数据:
|
加热前质量 |
加热后质量 |
|
|
W1(容器) |
W2(容器+晶体) |
W3(容器+无水硫酸铜) |
|
5.4 g |
7.9 g |
6.8 g |
请写出结晶水含量(x%)的计算公式(用W1、W2、W3表示)x%= 。
该生测定结果是偏高还是偏低? 。
从下列分析中选出该学生产生实验误差的原因可能是(填写字母) 。
A.加热前称量时容器未完全干燥 B.最后两次加热后的质量相差较大(大于0.1 g)
C.加热后容器未放入干燥器中冷却 D.加热过程中晶体有少量溅失
14、金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,(已知:氧化性Fe2+<Ni2+<Cu2+)下列叙述正确的是 ( )
A.阴极发生还原反应,其电极反应式:Ni2+ + 2e- = Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+
D.电解后,电解槽底部的阳极泥中只有Fe、Cu和Pt

第II卷(非选择题,共70分)
13、下列叙述不正确的是 ( )
A.用酒精清洗沾到皮肤上的苯酚
B.用氨水清洗试管壁附着的银镜
C.用过滤的方法分离油脂皂化反应的产物
D.用冷凝的方法从氨气、氮气和氢气混合气中分离出氨
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com