
题目列表(包括答案和解析)
23.(10)KMnO4溶液常用做氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此精确配制KMnO4标准溶液的操作是:
(1)称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸l h;
(2)用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;
(3)过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处:
(4)利用氧化还原滴定方法,在70℃-80℃条件下用基准试剂(纯度高、稳定性好的物质)溶液测定其浓度。
回答下列问题:
(1)为什么要称取稍多于所需的KMnO4固体?___________________________
(2)如何保证在70℃-80℃条件下进行滴定操作:_______________________
(3)下列物质中,可以用于测定KMnO4溶液浓度的基准试剂是________(填写序号)
A.H2C2O4·2H2O B.FeSO4·7H2O C.浓盐酸 D.Na2SO3
(4)若准确称取W g草酸晶体(H2C2O4·2H2O)溶于水配成500 mL水溶液,取25.00 mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,消耗高锰酸钾溶液V mL。
6H++2MnO4-+5H2C2O4·2H2O====2Mn2++10CO2↑+18H2O,问:
①滴定时,高锰酸钾溶液应装在________________;
②滴定终点标志是__________________;
③KMnO4溶液的物质的量浓度为__________________:
④若滴定前平视,滴定后俯视,则测得的浓度值将________(填“偏高”或偏低)
22.(15分)某教科书对“铝热反应”实验的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”,“纸漏斗的下部被烧穿,有熔融物落入沙中”。已知:Al、Fe的熔点、沸点数据如下:
|
物质 |
Al |
Fe |
|
熔点(℃) |
660 |
1535 |
|
沸点(℃) |
2467 |
2750 |
(1)某同学猜测,铝热反应所得到的熔融物是铁铝合金。根据已有知识找出一种验证产物中有Fe的方法: 。
(2)设计一个简单的实验方案,证明上述所得的熔融物中含有金属铝。请填写下列表格:
|
所用试剂 |
|
|
实验操作及现象 |
|
|
有关反应的化学方程式 |
|
(3)实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
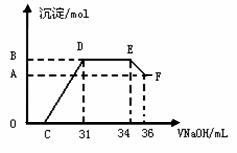 ①图中OC段没有沉淀生成,此阶段发生反应的离子方程式为
。
①图中OC段没有沉淀生成,此阶段发生反应的离子方程式为
。
②在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式
为 ;
③B与A的差值为 mol。
21.(4分)下列实验操作或事故处理中,正确的做法是
A.银镜反应实验后附有银的试管,可用稀H2SO4清洗
B.在粗盐的提纯实验中,溶解、过滤、蒸发都用到了玻璃棒
C.实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室。
D.配制FeCl3溶液时,将FeCl3固体溶于较浓盐酸中,然后再用水稀释到所需的浓度
E.制取乙酸乙酯时,先将乙醇和乙酸混合后再沿烧杯内壁缓慢注入浓硫酸中。
F.取1mL 20%蔗糖溶液,加入适量稀硫酸,水浴加热约5min后,再加入少量新制的
Cu(OH)2,加热,可检验蔗糖是否发生水解。
G.为了测定某溶液的pH,将用蒸馏水润湿的pH试纸浸入到待测溶液中,过一会取出,与标准比色卡进行对比
20.向一定量的Fe、FeO和Fe2O3的混合物中加入120mL 4mol/L的稀硝酸,恰好使混合物完全溶解,放出0.06 mol NO,往所得溶液中加入KSCN溶液,无血红色出现。若用足量的氢气在加热下还原相同质量的原混合物,能得到铁的物质的量为
A.0.24mol B.0.21mol C.0.16mol D.0.14mol
第Ⅱ卷 非选择题(共80分)
19.几种短周期元素的原子半径及主要化合价如下表:
|
元素代号 |
L |
M |
X |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.102 |
0.089 |
0.074 |
|
主要化合价 |
+2 |
+3 |
+6、-2 |
+2 |
-2 |
下列叙述正确的是
A.R的氧化物对应的水化物可能具有两性
B.X单质可在氧气中燃烧生成XO3
C.离子半径大小:r (M3+)<r (T2-)
D.L2+和X2-的核外电子数相等
17.在相同条件下,现将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序为:
①50mL0.01mol/LCaCl2溶液 ②50mL0.01mol/L的氨水
③50mL0.01mol/LAgNO3溶液 ④50mL蒸馏水
A. ②>①>③>④ B.②>④>③>①
C.④>②>①>③ D.④>③>②>①
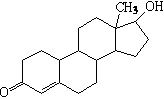 18.诺龙属于国际奥委会明确规定的违禁药物中的合成
18.诺龙属于国际奥委会明确规定的违禁药物中的合成
代谢类类固醇,其结构简式如右图所示。下列关于诺龙
性质的说法中不正确的是
A.能与氢气反应 B.能与金属钠反应
C.能与NaOH溶液反应 D.能与新制Cu(OH)2悬浊液反应
16.室温下,下列混合溶液中,各离子浓度的关系正确的是
A、pH=12的氨水溶液与pH=2的盐酸溶液等体积混合
c(NH4+)﹥c(Cl-)﹥c(OH-)﹥c(H+)
B、浓度均为0.1mol/L的硫酸氢铵溶液与氢氧化钠溶液等体积混合
c(Na+)﹥c(SO42-)﹥c(NH4+)﹥c(H+)﹥c(OH-)
C、浓度为0.1mol/L的碳酸钠溶液
c(Na+)+ c(H+)=2c(CO32-)+c(OH-)
D、浓度为0.1mol/L的醋酸钠溶液
c(Na+)=c(CH3COO-)﹥c(OH-)= c(H+)
15.锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时的电极反应式为
负极反应:C6Li-xe-===C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成的复合材料)
正极反应:Li1-xMO2+xLi++x e-===LiMO2(LiMO2表示含锂的过渡金属氧化物)
下列有关说法不正确的是
A.锂离子电池充电时电池反应为C6Li+Li1-xMO2===LiMO2+C6Li1-x
B.电池反应中,若锂、锌分别各失去1mol电子,金属锂所消耗的质量小
C.锂离子电池放电时电池内部Li+向负极移动
D.锂离子电池充电时阴极反应为C6Li1-x+xLi++x e-===C6Li
14.T℃时,在恒容密闭容器中,A、B、C三种气体反应浓度变化如图所示(a);若其他条件不变,温度分别为T1和T2时,B的含量变化如图(b)。则下列说法正确的是
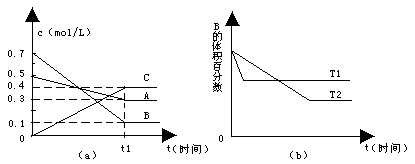
A.达到平衡后,升高温度,正、逆反应速率和A的转化率均增大
B.达到平衡后,保持其他条件不变,增大压强,平衡向逆反应方向移动
C.达到平衡后,保持压强不变,通入稀有气体,平衡向正反应方向移动
D、T℃时,若在该容器中由0.4mol/LA、0.4mol/LB和0.2mol/LC恒容开始反应,达到平衡后,C的浓度仍为0.4mol/L
13.下列离子方程式中错误的是
A.将SO2气体通入NaClO溶液中:SO2+2ClO-+H2O====SO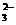 +2HClO
+2HClO
B.FeBr2溶液中通入过量Cl2:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
|
2H++SO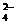 +Ba2++2OH-====BaSO4↓+2H2O
+Ba2++2OH-====BaSO4↓+2H2O
D.NH4HCO3溶液与过量NaOH溶液反应:NH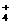 +OH-=NH3↑+H2O
+OH-=NH3↑+H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com