
题目列表(包括答案和解析)
5.以下“新闻”肯定是伪科学的是( )
A. 发现了铁元素+8价的化合物 B. 制得了能溶解任何物质的溶剂
C. 发现微量的NO有益健康 D. 找到了常温常压下合成氨的催化剂
4.以NA表示阿伏加德罗常数,下列判断错误的是( )
A. NA个质子的质量约为1 g B. 32 g S2和S4的混合物含有NA个S原子
C. 0.5 mol Na2O2含有NA个阴离子 D. 标准状况下, 1 mol己烷含有NA个分子
3.以下化学用语正确的是( )
A. 乙炔的最简式:CH≡CH B. 乙酸乙酯的分子式:C4H8O2
C. CO2的电子式: D. S2-的最外层电子排布式:3s23p4
D. S2-的最外层电子排布式:3s23p4
2.下列物质的俗名错误的是( )
A. Ca(OH)2:生石灰 B. HCHO:蚁醛 C. C6H5OH:石炭酸 D. Na2CO3:纯碱
1.下列物质与相应现象不相关的是( )
A. SO2:酸雨 B. CO2:温室效应
C. 氯气:富营养污染 D. 氟氯烃:臭氧层空洞
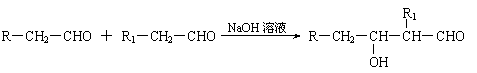 (1)凡与醛基直接相连的碳原子上的氢称为α-H原子,在稀碱溶液的催化作用下,一个醛分子上的α-H原子连接到另一个醛分子中醛基的氧原子上,其余部分连接到羰基碳原子上生成羟基醛,如:
(1)凡与醛基直接相连的碳原子上的氢称为α-H原子,在稀碱溶液的催化作用下,一个醛分子上的α-H原子连接到另一个醛分子中醛基的氧原子上,其余部分连接到羰基碳原子上生成羟基醛,如:
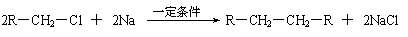 (2)
(2)

(3)
合成路线如下:
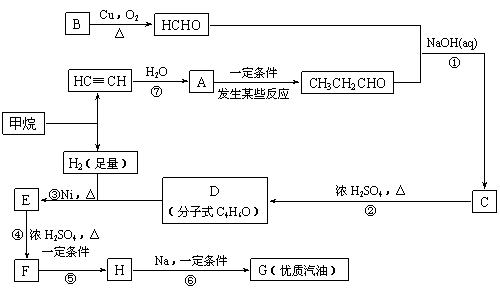
填空:
(1)在反应②-⑦中,属于加成反应的是 ,属于消去反应的是 。
(2)写出下列反应方程式
E → F: ;
H → G: 。
(3)H也能与NaOH溶液反应,其反应方程式为:
,
生成的有机物能否在Cu或Ag作催化剂的条件下被空气氧化 (选填“能”或“否”)。
29. (10分)新型节能材料高温超导体的最先突破是在1987年
(10分)新型节能材料高温超导体的最先突破是在1987年
从新的钇钡铜氧材料的研究开始的。钇钡铜氧的晶胞结构如图。研究发现,此高温超导体中的铜元素有两种价态:+2价和+3价(铜元素的原子序数为29)。
(1)写出铜在周期表中的位置(周期和族)
(2)写出Cu3+的核外电子排布:
(3)根据图示晶胞结构,推算晶体中Y,Cu,Ba和O原子个数比,确定其化学式为:
。
(4)根据(3)所推出的化合物的组成及各元素的化合价 (该化合物中Y、 Ba元素的化合价分别为+3价、+2价),计算化合物中两种价态Cu原子个数比为: 。
(5)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到的[Cu(NH3)4]SO4晶体中含有的化学键除了普通共价键外,还有 和 。
27.(10分)(1)苯、四氯化碳、乙醇、汽油是常见的有机溶剂,能与水互溶的是 ;不溶于水,且密度比水小的是 。
(2)一瓶无色气体,可能含有CH4和CH2==CH2,或其中的一种,与一瓶Cl2混合后光照,观察到黄绿色逐渐褪去,瓶壁有少量无色油状小液滴。
①由上述实验现象推断出该瓶气体中一定含有CH4,你认为是否正确,为什么?
。
②上述实验可能涉及的反应类型有 。
(3)含有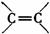 的化合物与CH2==CH2一样,在一定条件下可聚合成高分子化合物。
的化合物与CH2==CH2一样,在一定条件下可聚合成高分子化合物。
①广泛用作农用薄膜的聚氯乙烯塑料,是由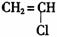 聚合而成的,其化学方程式是
聚合而成的,其化学方程式是
。
②电器包装中大量使用的泡沫塑料的主要成份是聚苯乙烯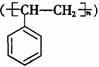 ,它是由 (写结构简式)聚合而成。
,它是由 (写结构简式)聚合而成。
26.(11分)空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:

(1) 溴在周期表中位于_________周期,_________族。
(2) 步骤①中用硫酸酸化可提高Cl2的利用率,为什么? 。
(3) 步骤④的离子方程式:________________________________________ 。
(4) 步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是_____________,分离时液溴从分离器的_____(填“上口”或“下口”)排出。
(5)为什么不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氯化”: 。
25.(10分)我国规定饮用水质量标准必须符合下列要求:
|
PH值 |
6.5-8.5 |
|
Ca2+,Mg2+总浓度 |
< 0.0045mol/L |
|
细菌总数 |
< 100个/mL |
以下是源水处理成自来水的工艺流程示意图

(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式____ _________
(2)凝聚剂除去悬浮固体颗粒的过程__________(填写编号,多选倒扣)
①只有物理过程 ②只是化学过程 ③是物理和化学过程
FeSO4·7H2O常用的凝聚剂,它在水中最终生成_____ ______沉淀。
(3)通入二氧化碳的目的是__________ _______和_______ ______。
(4)气体A通常使用氯气,氯气的作用是基于其和水反应的产物之一具有______________性,请写出氯气与水反应的离子反应方程式 。
(5)下列物质中能作为氯气的代用品的是 (填写编号,多选倒扣)
①Ca(ClO)2 ②NH3(液) ③K2FeO4 ④SO2
24.(10分)工业上合成氨是在一定条件下进行如下反应:
N2(g)+3H2(g)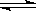 2NH3(g),△H = -92.44kJ/mol;其部分工艺流程如下:
2NH3(g),△H = -92.44kJ/mol;其部分工艺流程如下:
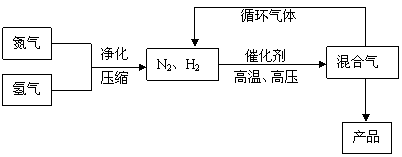
反应体系中各组分的部分性质见下表:
|
气体 |
氮气 |
氢气 |
氨 |
|
熔点(℃) |
-210.01 |
-252.77 |
-77.74 |
|
沸点(℃) |
-195.79 |
-259.23 |
-33.42 |
回答下列问题:
(1)写出该反应的化学平衡常数表达式:K= 。随着温度的升高,K值 (填增大、减小、不变)。
(2)平衡常数K值越大,表明 (填序号)。
A.N2的转化率越高 B.NH3的产率越大
C.原料中N2的含量越高 D.化学反应速率越快
(3)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过把混合气体的温度降低到 使 分离出来;继续循环的气体是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com