
题目列表(包括答案和解析)
3、有关热化学方程式书写与对应表述均正确的是
A、稀醋酸与0.1mol/LNaOH溶液反应:H+(aq)+OH-(aq)=H2O(l);△H=-57.3KJ/mol
|
热量。则Fe(s)+S(s)==FeS(s) ;△H=-95.6KJ/mol
C、氢气的燃烧热为285.5 KJ/mol,则水电解的热化学方程式:
 2H2O(l) 2H2(g)+O2(g);△H=+285.5 KJ/mol
2H2O(l) 2H2(g)+O2(g);△H=+285.5 KJ/mol
D、已知2C(s)+O2(g)=CO(g) ;△H=-221 KJ/mol,则可知C的燃烧热为110.5 KJ/mol
2、能保存在带磨口玻璃塞的无色试剂瓶中的物质是
A、.氟化钠溶液 B、浓硝酸 C、氯化铝溶液 D、碳酸钠溶液
1、2007年诺贝尔化学奖授予德国化学家格哈德·埃特尔是因为他在表面化学所作的开创性研究,他的方法不仅被用于学术研究而且被用于化学工业研发。下面选项与物质的表面特性无关的是
A、合成氨用铁粉做催化剂 B、用明矾来净水
C、用还原铁粉和石棉绒混合物与水蒸气制得Fe3O4和H2
D、配制FeCl3 溶液时将FeCl3固体溶于浓盐酸中再加水稀释
20.(10分)现有甲、乙两个容积相等的恒容密闭容器,向甲中通入6
mol A和2 mol B,向乙中通入1.5 mol A、0.5 mol B和3 mol C,将两容器的温度恒定为770 K,使反应3A (g) + B (g) xC(g)达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2。
xC(g)达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2。
请回答下列问题:
(1)若平衡时,甲、乙两容器中A的物质的量相等,则x = ______;若平衡时,甲、乙两容器中A的物质的量不相等,则x = ______。
(2)平衡时,甲、乙两容器中A、B的物质的量之比是否相等?_______(填“相等”或“不相等”),平衡时甲中A的体积分数为_______。
(3)若平衡时两容器中的压强不相等,则两容器中压强之比为________。
19.(18分)下图是一个制取氯气并以氯气为原料进行特定反应的装置,请回答下列问题。
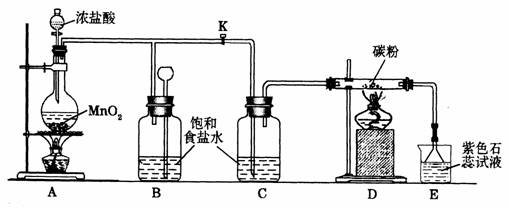
(1)A是氯气发生装置,其中发生的反应的化学方程式为________________。
(2)实验开始时,先点燃装置A处的酒精灯,打开弹簧夹K,让Cl2充满整个装置,再点装置D处的酒精灯,Cl2通过C瓶后再进入D(D装置的硬质玻璃管内盛有碳粉)发生氧化还原反应,其产物为CO2和HCl。D中发生反应的化学方程式为_____________________,装置C的作用是______________________。
(3)实验过程中,E处产生的现象为___________________________。
(4)D处反应完毕后,关闭弹簧夹K,移去酒精灯,由于余热的作用,A处仍有Cl2产生,此时B中出现的现象是________________________,装置B的作用是________________。
(5)若实验中使12 mol · L – 1的浓盐酸10 mL与足量的MnO2反应,则生成的Cl2的物质的量总是小于0.03 mol,其原因是__________________________。
(6)若要吸收从硬质玻璃管中导出的气体,E中应盛放__________溶液,其中有毒气体与之反应的离子方程式是_________________________。
18.(16分)已知物质A显酸性,F为七原子组成的环状物,请根据以下框图回答问题:
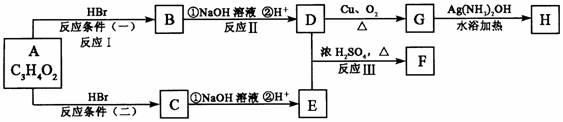
(1)写出下列物质的结构简式:A:__________________,G:__________________。
(2)反应Ⅰ、Ⅱ、Ⅲ的反应类型分别为__________、_________、_________。
(3)写出D和E反应生成F的化学方程式:_______________________。
(4)写出C的同分异构体中属于酯类物质的结构简式:(任写两种)________、________。
17.(16分)下列各物质为中学化学中常见物质,其中A、C、E、F为气体,B、D为无色液体,D是一种重要的化工原料,F的浓溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B分子中有18个电子。反应中部分生成物已略去。
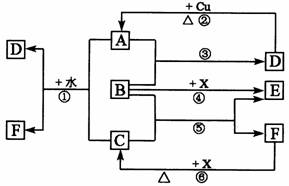
试回答下列问题:
(1)根据图中信息,B、C、D、X氧化性从强到弱的顺序是_________。(用对应物质的化学式表示)
(2)B的电子式为:_________________________。
(3)写出反应②的化学方程式:______________________。
(4)写出反应①、⑥的离子方程式:
①__________________________________________________;
⑥__________________________________________________。
16.某烃的衍生物含碳40%,该有机物的相对分子质量必定是下列数值中某一数值的n倍(n倍为正整数),该数值是 ( )
A.20 B.30 C.40 D.50
15.下列电极反应中,既可能是原电池中的电极反应,又可能是电解槽中的电极反应的是
( )
A.2H++2e- H2↑ B.H2-2e-=2H+
C.O2+4e-+2H2O=4OH- D.4OH--4e-=O2↑+2H2O
14.两种电解装置:①以铜为电极对Na2SO4溶液进行电解 ②以铂为电极对Na2SO4溶液进行电解当两装置中产生的氢气质量相同,两装置消耗的水的质量之比为 ( )
A.1:1 B.2:1
C.1:2 D.有一装置不消耗水,无法比较
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com