
题目列表(包括答案和解析)
13、 25℃时,水的电离达到平衡:H2O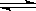 H++OH-;ΔH>0,下列叙述正确的是
H++OH-;ΔH>0,下列叙述正确的是
A、 向水中加入稀氨水,平衡逆向移动,c(OH―)降低
B、 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C、 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D、 将水加热,Kw增大,pH不变
12、用已知浓度的盐酸测定未知浓度的NaOH溶液的物质的量浓度,进行酸碱中和滴定时,将碱滴入酸中,下列操作都会使测定结果偏低的是(锥形瓶中溶液用滴定管量取)
A、碱式滴定管未用待测碱液润洗 B、酸式滴定管未用标准盐酸润洗
C、滴定过程中不慎锥形瓶中有液体溅出 D、滴定前仰视读数,滴定后读数正确
11、表示0.1mol·L-1NaHCO3溶液有关微粒浓度的关系正确的
A、c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) B、c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
C、c(Na+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-) D、c(OH-)=c(H+)+c(H2CO3)+c(HCO3-)
10、在一定温度下,可逆反应:2HI(g) 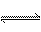 H2(g)+I2(g),△H>0,已知平衡状态改变某一条件时,混合气体的颜色加深。则下列说法正确的是
H2(g)+I2(g),△H>0,已知平衡状态改变某一条件时,混合气体的颜色加深。则下列说法正确的是
A、改变的条件可能是在恒容条件下,充入HI气体
B、改变的条件可能是在恒压条件下,充入HI气体
C、化学平衡一定向正反应方向移动
D、正反应速率增大,逆反应速度一定减小
9、下列物质的提纯或离子检验的方法正确的是
A、用渗析的方法精制氢氧化铁胶体
B、以精铜为阳极,粗铜为阴极,CuSO4溶液为电解液精炼铜
C、除去KCl溶液中的少量MgCl2,加入过量KOH溶液,然后过滤即可
D、加入澄清的石灰水,能产生白色沉淀,则原溶液中一定含有CO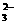
8、下列叙述正确的是
① 锌跟稀硫酸反应制H2,加入少量硫酸铜溶液能加快反应速率;
② 镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易腐蚀;
③ 电镀时,应把镀件置于电解槽的阴极;
④ 冶炼铝时,把氧化铝加入液态冰晶石中成为熔融体后电解;
⑤ 钢铁表面常易腐蚀生成Fe2O3·nH2O
A、全部 B、①③④⑤ C、①③⑤ D、②④
7、在含有Cu(NO3)2、Zn(NO3)2 Fe(NO3)3、AgNO3各0.1mol的混合溶液中加入0.1molFe
粉,充分搅拌后铁溶解,溶液中不存在Fe3+离子,同时析出0.1molAg。则下列结论中不
正确的是
A、溶液中Cu2+与Fe2+的物质的量之比为1:2 B、氧化性:Ag+>Cu2+>Fe3+>Zn2+
C、Fe3+的氧化性大于Cu2+ D、1molFe可还原2molFe3+
6、下列离子方程式正确的是
A、过量的NaHSO4和Ba(OH)2溶液反应:H+ + SO42- + Ba2+ + OH- == BaSO4↓ +2H2O
B、NH4HCO3和过量NaOH溶液相混合:HCO3- + OH- == CO32- + H2O
C、NaHSO4溶液中滴加NaHCO3溶液:H+ + HCO3- == H2O + CO2↑
D、用氨水吸收少量的SO2:NH3 + H2O + SO2 == NH4+ + HSO3-
5、用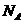 表示阿伏加德罗常数的数值,下列说法正确的是
表示阿伏加德罗常数的数值,下列说法正确的是
A、在标准状况下,VL水含有的氧原子个数为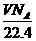
B、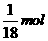 的
的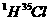 分子所含中子数为
分子所含中子数为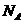
C、1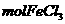 与水完全反应转化为氢氧化铁胶体后,其中胶体粒子的数目为
与水完全反应转化为氢氧化铁胶体后,其中胶体粒子的数目为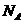
D、常温时1 L 1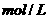 的醋酸溶液中,所含醋酸分子数为
的醋酸溶液中,所含醋酸分子数为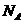
4、下列有关说法中,正确的是
A、溶液中c(H+)越大,pH值也越大,溶液的酸性就越强
B、pH=3和pH=4的盐酸各10mL混合,所得溶液的pH=3.5
C、三种氢化物的沸点高低:HBr>HCl>HF
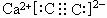 D、CaC2的电子式为
D、CaC2的电子式为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com