
题目列表(包括答案和解析)
6.二○○八年北京残奥会吉祥物是以牛为形象设计的“福牛乐乐”(Funiulele)。有一种有机物的键线式也酷似牛,故称为牛式二烯炔醇(cowenynenynol)。已知连有四个不同的原子或原子团的碳原子,称为手性碳原子。下列有关说法不正确的是
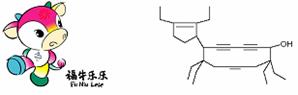
A.牛式二烯炔醇含有3种官能团
B.牛式二烯炔醇含有3个手性碳原子
C.1mol牛式二烯炔醇最多可与6molBr2发生加成反应
D.牛式二烯炔醇分子内能发生消去反应
5.下列反应最终无沉淀产生的是
① 过量的CO2通入Na2SiO3溶液中 ② 向AgNO3溶液中滴加稀氨水至过量
③ 少量的SO2通入BaCl2溶液中 ④ 向MgCl2溶液中滴加NaOH溶液至过量
A.①② B.②④ C.②③ D.①④
4.右表为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述正确的是
|
|
|||
|
A |
B |
C |
|
|
|
|
D |
|
|
|
A.原子半径大小比较为A>B>C>D
B.生成的氢化物稳定性为A>B>C>D
C.A与C形成的阴离子可能有AC32-、A2C42-
D.A、B、C、D的单质常温下均不导电
3.下列各组离子能在同一溶液中大量共存的是
A.Cu2+、K+、S2-、Cl- B.NH4+、Na+、SO42-、AlO2-
C.Na+、HCO3-、Ba2+、NO3- D.H+、Ba2+、NO3-、I-
2.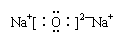 下列表达式中错误的是
下列表达式中错误的是
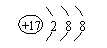 A.氨分子的电子式:
B.氧化钠的电子式:
A.氨分子的电子式:
B.氧化钠的电子式:
C.氯离子的离子结构示意图 :
D.硫离子的核外电子排布式: 1s22s22p63s23p4
1.人体内的微量元素共有20多种,这些总和虽不足人体质量的千分之一,但对机体的生理作用却不可忽视,碘元素就是其中的一种,人类日常食用的加碘盐是指在食盐中加入了
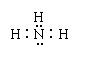 A.单质碘 B.碘化钾 C.碘酸钾 D.含碘有机物
A.单质碘 B.碘化钾 C.碘酸钾 D.含碘有机物
26、某工厂排出的废水中含有金属Ba2+,为了测定其浓度,作如下实验:
①称取K2Cr2O7固体0.1323g溶于适量的稀硫酸中,再向其中加入过量KI,反应后用Na2S2O3 溶液与之反应,当用去27.00mL时恰好完全反应。
②另取废水50.00mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀,沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时 CrO42- 转化为 Cr2O72-,再加过量KI反应,反应液再同上述Na2S2O3 溶液反应,反应完全时,消耗Na2S2O3 溶液24.00mL,已知有关的离子方程式为:
_____Cr2O72-+____I-+______H+=______Cr3++_____I2+____ ______
I2+2S2O32-=2I-+S4O62-
(1)配平上述方程式。
(2)Na2S2O3 溶液的浓度为__________。
(3)求废水中Ba2+的物质的量浓度是多少?
25、 已知:有机物A是一种镇痛解热药品,其结构简式为:
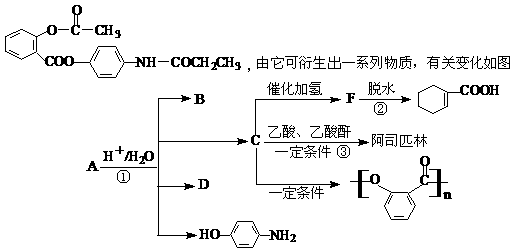
(1)B、D的关系是 (填序号)。
a.互为同位素 b.互为同系物 c.互为同分异构体 d.同类物质
(2)写出②③反应的化学方程式,注明反应类型
反应② ; 。
反应③ ; 。
(3)能与FeCl3溶液发生显色反应的属于酯类的C的同分异构体有 种。
24、A为日常调味品之一,K胶体经过处理可用作干燥剂,F为白色腊状固体,B为无色无
味液体。请回答下列问题:
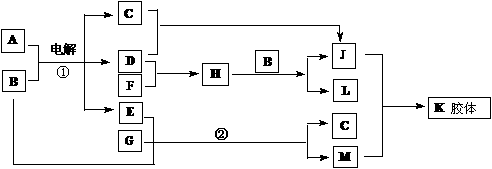
(1)写出下列物质化学式:
A:________; D:________;E:________;
(2)判断晶体A、F、G的熔点高低(用化学式表示)________>_________>______
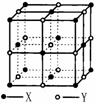 (3)晶体A由两种微粒构成,其晶体结构如图所示,
(3)晶体A由两种微粒构成,其晶体结构如图所示,
相邻最近异种微粒间距为a cm,晶体A的密度为
ρ g/cm3,则用相关数据表达阿伏加德罗常数
NA=__________________。
(4)写出反应②的离子方程式________________。
(5)铁锅与A的溶液接触时容易生锈,可以用方程式表示其原因:
①负极反应:______________正极反应:_______________
② Fe2++2OH-=Fe(OH)2
③__________________________________________________
④ 2Fe(OH)3 + (x-3)H2O==Fe2O3·xH2O(铁锈)
23.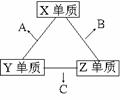 X、Y、Z三种短周期元素,它们的原子序数之和为16。
X、Y、Z三种短周期元素,它们的原子序数之和为16。
X、Y、Z三种元素的常见单质在常温下都是无色气体,
在适当条件下可发生如右变化:
一个B分子中含有的Z原子个数比C分子中少1个。
请回答下列问题:
(1)X元素在周期表中的位置是第 周期 族。
(2)分析同主族元素性质的递变规律,发现B、C物质沸点反常,这是因为它们的分子之间存在 。
(3)①C的电子式是 ,C分子的结构呈 形。
②C在一定条件下反应生成A的化学方程式是 。
③X、Y、Z三种元素可组成一种强酸W,C在适当条件下被W吸收生成一种盐。该盐的水溶液pH 7(填“大于”、“小于”、“等于”),其原因是(写出离子方程式): 。
(4)已知Y单质与Z单质生成C的反应是可逆反应,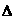 H<0。将等物质的量的Y、Z两种单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法正确的有 。
H<0。将等物质的量的Y、Z两种单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法正确的有 。
A、达到化学平衡时,正反应速率和逆反应速率相等
B、达到化学平衡时,Y、Z两种单质在混合气体中的物质的量之比为1:1
C、达到化学平衡的过程中气体平均相对分子质量减小
D、达到化学平衡后,升高温度,C的体积分数减小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com