
题目列表(包括答案和解析)
16.将质量为W1g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体V1L。向溶液中逐滴加入浓度为a mol·L-1的HC1溶液,过程中有白色沉淀产生后又逐渐溶解,当沉淀恰好消失时所加HC1溶液体积为V2L。将溶液蒸干充分灼烧得到固体W2g。下列关系式中错误的是 ( )
A.24n(A1)+35.5n(Na)=W2-W1 B.n(Na)+3n(A1)=aV2
C.n(Na)+3n(A1)=V1/11.2 D.aV2=V1/22.4
第Ⅱ卷(共72分)
15.氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为
a HClO3 = bO2↑+ c Cl2↑+ d HClO4 + e H2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法正确的是
A.由反应可确定:氧化性HClO4>HClO3
B.变蓝的淀粉碘化钾试纸褪色是因为可能发生了:
5C12 + I2 + 6H2O = 12H+ + 10Cl- + 2IO3-
C.若氯酸分解所得混合气体,lmol混合气体质量为52.5g,则反应方程式可表示
26HClO3 = 15O2↑+ 8C12↑+ 10HClO4 + 8H2O
D.若化学计量数a=8,b=3,则该反应转移电子数为20e-
14.为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是 ( )
|
|
被提纯的物质 |
除杂试剂 |
分离方法 |
|
A |
溴化钠溶液(NaI) |
氯水、CCl4 |
萃取、分液 |
|
B |
氯化铵溶液(FeCl3) |
NaOH |
过滤 |
|
C |
乙酸乙酯(CH3COOH) |
饱和Na2CO3溶液 |
分液 |
|
D |
苯(苯酚) |
溴水 |
过滤 |
13.NA表示阿伏加德罗常数,下列叙述中正确的是
A.0.1mol Fe 与0.1mol Cl2充分反应,转移的电子数为0.3 NA
B.标准状况下,11.2 L NO2和11.2 LN2O4的混合物所含的分子数为1.5 NA
C.2.0gD2O中所含中子数为0.1NA
D.常温常压下,22 g 氧气和26 g 臭氧所含氧原子总数为3 NA
12..类推是化学学习和研究中常用的思维方法。下列类推正确的是
A.Mg可由电解熔融MgCl2制取,Al也可由电解熔融AlCl3制取
B.金属Na着火不能用干冰灭火,金属K着火也不能用干冰灭火
C.SO2能使品红溶液褪色,CO2也能使品红溶液褪色
D.F2、Cl2、Br2、I2的熔点依次升高,N2、P4、As、Sb、Bi的熔点也依次升高
11.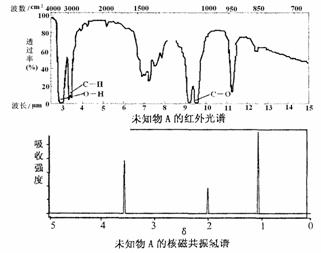 已知某有机物A的红外光谱和核磁共振氢谱如下图所示,下列说法中不正确的是
已知某有机物A的红外光谱和核磁共振氢谱如下图所示,下列说法中不正确的是
A.由红光外谱可知,该有机物中至少有三种不同的化学键
B.由核磁共振氢谱可知,该有机物分子中有三种不同的氢原子
C.仅由其核磁共振氢谱无法得知其分子中的氢原子总数
D.若A的化学式为C2H6O,则其结构简式为CH3-O-CH3
10.有一瓶无色气体,可能含有H2S、CO2、HBr、HCl、SO2中的一种或几种。向其中加入过量氯水,得到无色透明溶液,把溶液分成两份;向其中一份加入盐酸酸化的BaCl2溶液,出现白色沉淀;向另一份中加入硝酸酸化的AgNO3溶液,也有白色沉淀。则下列结论正确的是
A.原气体中肯定有SO2 B.原气体中肯定没有H2S和HBr
C.原气体中肯定有SO2和HCl D.原气体中肯定没有CO2
9.下列说法中正确的是
A.测定溶液的pH值,应先将pH试纸用蒸馏水润湿
B.称量加热后的固体时,均需先将固体在空气中冷却后再称量
C.配制0.1mol/LNa2CO3溶液时,容量瓶应先用0.1mol/L Na2CO3润洗
D.皮肤上沾有少量浓硫酸,可立即用大量水冲洗
8.下列离子方程式书写错误的是
A.FeCl2溶液中通入Cl2:2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
B.AlCl3溶液中加入过量氨水:Al3+ + 4OH-= AlO2- + 2H2O
C.次氯酸钙溶液中通入过量的二氧化碳:
ClO- + CO2 + H2O = HClO + HCO3-
D.FeS固体放入稀硫酸溶液中:FeS + 2H+ = Fe2+ + H2S↑
7.已知氯化铁溶液中通入硫化氢可发生反应:2FeCl3+H2S→2FeCl2+S↓+2HCl。在标准状况下,向100mLFeCl3溶液中通入a L的H2S气体恰好反应后,再加入足量的铁粉充分反应。所得溶液经测定金属阳离子的浓度为3mol/L,若反应过程中溶液体积不变,则原FeCl3溶液的物质的量浓度为
A.1.5mol/L B.1 mol/L C.2 mol/L D.无法确定
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com