
题目列表(包括答案和解析)
1.2007年诺贝尔化学奖获得者德国科学家格哈德·埃特尔在表面化学研究领域作出了开拓性贡献。化学家将研究气体与固体(或液体)在界面上所发生的物理化学现象的科学称为表面化学。对下列现象的研究不属于表面化学范畴的是
A.氯化银在水中的溶解平衡 B.氢氧燃料电池中电极上的反应
C.铁在潮湿的空气中生锈 D.氮气与氢气在铁触媒作用下化合
23. 已知金属M是用途广泛的常见金属,且常将铝粉与M等金属氧化物的混合物称为“铝热剂”,因其在在一定条件下经引发反应放出大量的热,因此这类反应称为“铝热反应”。例如:
2Al+M2O3 Al2O3+2M
Al2O3+2M
“铝热反应”在金属冶炼等生产实践中应用广泛。
I.(1)若M是第四周期元素,且基态原子中未成对电子数与其所在周期数相同,请写出M的核外电子排布式 。试用原子结构理论解释M2+离子具有较强还原性(M2+→M3+)的原因:
。
(2)经查阅《化学手册》知,Al、Al2O3、M、M2O3熔点、沸点数据如下:
|
物质 |
Al |
Al2O3 |
M |
M2O3 |
|
熔点/℃ |
660 |
2054 |
1535 |
1462 |
|
沸点/℃ |
2467 |
2980 |
2750 |
- |
因此某同学推测,铝热反应所得到的熔融物可能是M和少量铝的合金。理由是: 。
II.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关
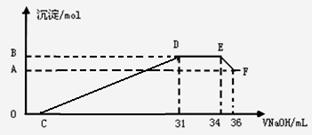 系如图所示。试回答下列问题:
系如图所示。试回答下列问题:
(3)图中OC段没有沉淀生成,此阶段发生反应
的离子方程式为 。
(4)在DE段,沉淀的物质的量没有变化,则此阶
段发生反应的离子方程式为 ;
(5)B与A的差值为 mol。
(6)B点对应的沉淀的物质的量为 mol,C点对应的氢氧化钠溶液的体积为 mL
22. 中国的二氧化硫排放量居世界第一。因此国家环保总
中国的二氧化硫排放量居世界第一。因此国家环保总
局“2006年环境监测公报”指出,减少SO2的排放和生活
废水的处理是我国“十一五”期间环境保护的主要任务。
请回答下列问题:
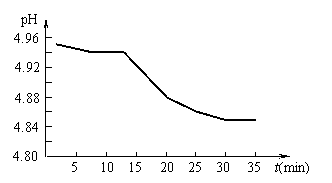
Ⅰ.SO2的排放是造成酸雨的主要因素之一。某地区酸雨
的pH随时间的变化如右图所示。请用化学方程式表示该
变化的原因 。
Ⅱ.(1)工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。为了保护环境,同时提高硫酸工业的综合经济效益,工业上采用了新型氨法烟气脱硫技术采用氨吸收烟气中SO2,该技术的优点是 。
(2)将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个反应的化学方程式:
; 。
(3)为进一步减少SO2的污染并变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2。该方法涉及到的化学反应为:SO2+2CO=2CO2+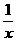 Sx 、CO+
Sx 、CO+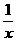 Sx=COS、
Sx=COS、
2COS+SO2=2CO2+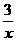 Sx 。其中COS分子的空间构型为 。
Sx 。其中COS分子的空间构型为 。
21.(10分)1919年,Langmuir提出,电子数相同、原子数相同的分子,互称为等电子体。以后又发展成
具有相同价电子(最外层电子)数和相同原子数的分子和离子也称等电子体。已知X是短周期元素组成的一
种新型无机非金属材料,它与碳化硅(SiC)结构相似,物理性质相近,符合“等电子体原理”。X有如下转
化关系(图中部分反应条件及部分生产物中的水已略去):其中,C是一种能使湿润的红色石蕊试纸变蓝的
无色气体,D为白色胶状沉淀,E溶液的焰色反应呈黄色,G是空气的主要成分之一。
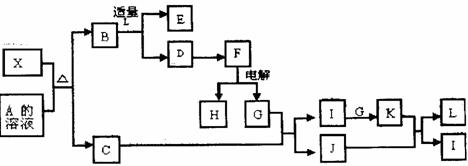
试回答下列问题:
(1)X属于 晶体(填“分子”、“原子”或“离子”);
(2)若仅根据“等电子体原理”,猜想X物质的化学式可能是 ;
(3)分子C的空间构型为 ;
(4)①写出X与A溶液反应的离子方程式: ;
②写出C与G反应的化学方程式: 。
20.(10分)虽然氟元素早在1810年就被发现,但170多年来化学家试图用化学方法制取氟单质的尝试
一直未获成功。直到1986年,化学家Karl Christe首次用化学方法制得了F2。他提出的三步反应如下(反
应①、②里氟元素化合价不变):
①KMnO4+KF+H2O2+HF→K2MnF6+ +H2O
②SbCl5+HF→SbF5+
③2K2MnF6+4SbF5= 4KSbF6+2MnF3+F2↑
请根据以上反应回答问题:
(1)反应①中空格上应填物质的化学式为 ;为什么填这一物质,试用氧化还原反应理论解释:
;并配平反应① 。
(2)完成反应②: 。
(3)反应③中的氧化剂为 ;被氧化的元素为 。
19.(10分)元素周期律是20世纪科学技术发展的重要理论依据之一。已知A、B、C、D、E五种元素都
是元素周期表中前20号元素。A、B、C、D四种元素在元素周期表(长式)中的相对位置如下图所示,B、
C、D的最高价氧化物的水化物两两混合,均能发生反应生成盐和水。E元素原子序数均大于A、B、C、D
元素,且不与A、B、C、D元素位于同主族。
|
|
|
|
|
…… |
|
A |
|
|
|
B |
|
C |
D |
|
|
根据以上信息,回答下列问题:
(1)上述五种元素中第一电离能最小的是 ,电负性最大的是 。(填相关元素的元素
符号)
(2)A和D的氢化物中,沸点较高的是 (填相关物质的分子式);其原因是 。
 (3)A和E可组成离子化合物,其晶胞(在晶体中具有代表性的最小重复单元)结构如下图所示,
(3)A和E可组成离子化合物,其晶胞(在晶体中具有代表性的最小重复单元)结构如下图所示,
阳离子位于该正方体的顶点或面心;阴离子均位于小正方体中心。该化合物的电子式为 。
18.(12分)铜及其化合物一般都具有特征的颜色,例如Cu、Cu2O呈红色,CuO呈黑色,CuSO4·5H2O呈蓝色等。研究性学习小组甲为检测实验室的Cu2O试样中是否含有Cu进行了认真的探究。
Ⅰ.查阅资料:①Cu2O属于碱性氧化物; ②在空气中灼烧Cu2O生成CuO;③Cu2O在酸性条件下能发生自身氧化还原反应(Cu2O+2H+=Cu+Cu2++H2O)。
Ⅱ.设计实验方案:
方案1:取该红色试样溶于足量的稀硝酸中,观察溶液颜色变化
方案2:取该红色试样溶于足量的稀硫酸中,观察是否有残渣
方案3:称得干燥坩埚的质量为a g ,取红色试样置于坩埚中称得总质量为b g,在空气中充分灼烧至完全变黑,并在干燥器中冷却,再称量。如此反复多次直到质量不变,称得最后质量为c g。分析数据,作出合理判断。
(1)请你评价方案1和方案2。如果你认为该方案合理,请简述其工作原理;如果你认为该方案不合理,请简述原因。
。
(2)方案3中,如果a、b、c的关系符合c= 可确认红色粉末是Cu2O。
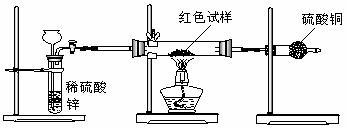 Ⅲ.研究性学习小组乙,设计了新的探究方案,装置如图所示。
Ⅲ.研究性学习小组乙,设计了新的探究方案,装置如图所示。
(3)简述新探究方案中,气体发生装置的气密性如何检验(操作、现象、结论):
。
(4)你认为依据新方案测定上述红色试样成分必须获得下列哪些物理量:(选填序号) 。
①通入氢气体积;②反应前,红色试样+硬质试管的总质量;③完全反应后红色固体+硬质试管的总质量;④实验前,干燥管(含药品)的质量;⑤硬质试管质量;⑥锌粒质量;⑦稀硫酸中含溶质的量;⑧实验后,干燥管(含药品)的质量
(5)有人提出,在氢气发生器与硬质试管之间应加一个干燥装置,你认为 (选填“需要”或“不
需要”),简述理由 。
17.(8分)在足量的稀氯化亚铁溶液中加入1-2滴液溴,振荡后溶液变为黄色。
(1)甲同学认为是Br2溶于水变成黄色溶液 ; 乙认为是Fe2+被氧化成Fe3+使溶液变成黄色。
(2)现提供试剂:
A.酸性高锰酸钾溶液 B.氢氧化钠溶液 C.四氯化碳 D.硫氰化钾溶液
请判断 (填“甲”或“乙”)的推断正确,并用两种方法加以验证,写出选用的试剂编号及实验中观察到的现象:
|
|
选用试剂 |
实验现象 |
|
第一种方法 |
|
|
|
第二种方法 |
|
|
(3)若选用淀粉碘化钾溶液判断哪位同学的推断正确,是否可行?(填“可行”或“不可行”): ;理由: ;
16.将15.6g Na2O2和5.4g Al同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入HCl气体6.72L(标准状况),若忽略反应过程中溶液的体积变化,则下列判断正确的是
A.反应过程中得到6.72L(标准状况)的气体 B.最终得到7.8g的沉淀
C.最终得到的溶液中c(NaCl)=1.5mo/L D.最终得到的溶液中c(Na+)=c(Cl-)+c(OH-)
第Ⅱ卷(共72分)
15.已知:X、Y是同周期的主族元素,且电负性X>Y,下列说法错误的是:
A.X与Y形成化合物是,X可以显负价,Y显正价
B.第一电离能可能Y小于X
C.最高价含氧酸的酸性:X对应的酸性弱于于Y对应的酸性
D.气态氢化物的稳定性:HmY小于HmX
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com