
题目列表(包括答案和解析)
27.(12分)如下图所示的装置,C、D、E、F、X、Y都是惰性电极。
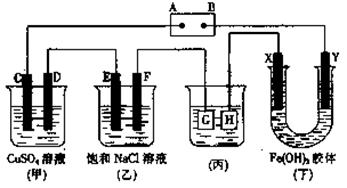
将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答以下问题:
(1)电源A极的名称是___ ____。
(2)甲装置中电解反应的总反应离子方程式是:___________________________ 。
(3)如果收集乙装置中产生的气体,两种气体的体积比是______ ______。
(4)欲用丙装置给铜镀一层银,G应该是_______(填“铜”或“银”),电镀液的主要成分是______ ___(填化学式)。
(5)装置丁中的现象是______________________,说明________ _____ 。
26.(4分)下列实验操作或对实验事实的叙述正确的是_________ __(填序号):
①用碱式滴定管量取20.00 mL 0.10mol/L KMnO4溶液;
②用托盘天平称取10.50 g干燥的NaCl固体;
③各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘纸上称量;
④配制Al2(SO4)3溶液时,加入少量的稀硫酸;
⑤将未经湿润的pH试纸浸到某溶液中,过一会取出与标准比色卡比较测得该溶液的pH;
⑥中和滴定中,锥形瓶用蒸馏水洗净后可直接往其中注入一定量的待测溶液;
⑦测定硫酸铜晶体中结晶水含量的实验至少需要加热2次,至少需要称量4次。
25.下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
|
A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
B |
C |
D |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
E |
F |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)B和E的最高价氧化物对应的水化物中酸性较强的是 (填化学式),
写出可以验证该结论的一个离子反应方程式 。
(2)王水可溶解不能与硝酸反应的金属如Au、Pt等,其原因是王水中不仅含有HNO3、还有反应生成的Cl2和NOCl,假设NOCl中所有原子都达到了8电子稳定结构,试写出NOCl的电子式 。
(3)EBC-和A2D2在碱性条件下反应生成了ED42-和可参加大气循环的两种无毒无害气体及水,试写出该反应的离子方程式 。
24.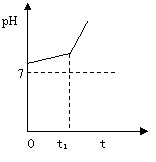 (6分)用惰性电极电解NaCl与NaHCO3混合溶液,
(6分)用惰性电极电解NaCl与NaHCO3混合溶液,
测得溶液pH变化如下图所示。
① 在0→t时间内,两个电极上的电极反应式为:
阳极 ;
阴极 。
②用离子方程式表明0→t1时间内,溶液pH升高
比较缓慢的原因:
。
23.(4分)回答下列问题:
(1)保持恒温,向pH=6的蒸馏水中加入2.3g金属钠,充分反应后,再加蒸馏水稀释到1L,所得溶液的pH= 。
(2)向pH=6的蒸馏水和c(H+)=10-6mol·L-1的稀盐酸中分别投入大小、质量相同的金属钠,反应刚开始时,产生H2的速率前者与后者相比是 (填选项序号)。
A.一样快 B.前者快 C.后者快 D.无法比较
21.常温下,下列有关叙述正确的是: ( )
A.Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
B.NaB溶液的pH=8,c(Na+)-c(B-)=0.99×10-6mol/L
C.pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH4+)大小顺序①=②>③
D.10mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≥20mL
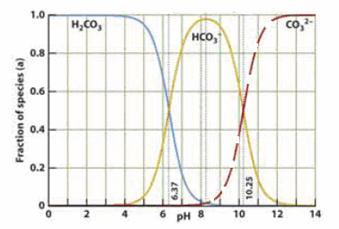 22.下图是一水溶液在pH从 0至14的范围内,H2CO3、HCO3-、CO32-三种成分平衡时的组成百分率[H2CO3]、[HCO3-]、[CO32-],下列叙述正确的是 ( )
22.下图是一水溶液在pH从 0至14的范围内,H2CO3、HCO3-、CO32-三种成分平衡时的组成百分率[H2CO3]、[HCO3-]、[CO32-],下列叙述正确的是 ( )
A.此图可完全根据1.0 mol/LHCl溶液滴定1.0mol/L碳酸钠溶液的实验数据绘出
B.1.0 mol/LHCl溶液滴定1.0mol/L碳酸钠溶液恰好反应时呈中性
C.二氧化碳溶解在血液中多以HCO3-的形式存在
D.在pH为6.37及10.25时,溶液中[H2CO3]=[HCO3-]=[CO32-]
第Ⅱ卷(共44分)
|
20.在一定条件下化学反应:2SO2(g)+O2(g) 2SO3(g);△H=-197kJ/mol。现有容积相同的甲、乙、丙三个容器,在上述条件下分别充入的气体和达到平衡时反应放出的热量(Q)如下表所列:
2SO3(g);△H=-197kJ/mol。现有容积相同的甲、乙、丙三个容器,在上述条件下分别充入的气体和达到平衡时反应放出的热量(Q)如下表所列:
|
容 器 |
SO2(mol) |
O2(mol) |
N2(mol) |
Q(kJ) |
|
甲 |
2 |
1 |
0 |
Q1 |
|
乙 |
1 |
0.5 |
0 |
Q2 |
|
丙 |
1 |
0.5 |
1 |
Q3 |
根据以上数据,下列叙述不正确的是 ( )
A.Q1=2Q2=2Q3=197
B.在上述条件下每消耗2摩SO2气体时放出的热量为197 kJ
C.在上述条件下反应生成1 molSO3气体放热98.5 kJ
D.2Q2=2Q3<Q1<197 kJ
19.有BaCl2和NaCl的混合溶液aL,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。据此得知原混合溶液中的c (Na+) (单位: mol·L-1)为: ( )
A.(y-2x)/a B.(y-x)/a C.(2y-2x)/a D.(2y-4x)/a
18.短周期元素A、B、C的原子序数依次递增,它们的原子最外层电子数之和为10,A与C同主族,B原子的最外层电子数等于A原子的次外层电子数,则下列叙述正确的是( )
A.原子半径:A<B<C
B.A的氢化物稳定性大于C的氢化物稳定性
C.三种元素的最高价氧化物对应水化物均可由化合反应得到
D.高温下,A单质能置换出C单质
17.某无色溶液可能有Na2CO3、MgCl2、NaHCO3、BaCl2中的一种或几种。在该溶液中加入NaOH溶液时出现白色沉淀;若加入稀H2SO4,既有白色沉淀又有气体放出。则下列判断中正确的是: ( )
A.肯定有BaCl2 B.一定有MgCl2
C.肯定无NaHCO3 D.Na2 CO3、NaHCO3至少存在一种
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com