
题目列表(包括答案和解析)
8. 某密闭容器中进行如下反应:2X(g)+Y(g)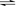 2Z(g),若要使平衡时反应物总物质的量与生成物的物质的量相等,且用X、Y作反应物,则X、Y的初始物质的量之比的范围应满足
2Z(g),若要使平衡时反应物总物质的量与生成物的物质的量相等,且用X、Y作反应物,则X、Y的初始物质的量之比的范围应满足
A. 1<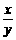 <3 B.
<3 B. 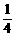 <
<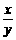 <
<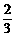 C.
C. 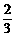 <
<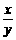 <4 D.
<4 D. 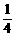 <
<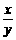 <
<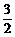
7.运用元素周期律分析下面的推断,其中错误的是:①铍(Be)的最高价氧化物的水化物可能具有两性;②铊(Tl)既能与盐酸作用产生氢气,又能跟NaOH溶液反应放出氢气,Tl(NO3)3溶液的酸性很强;③砹(At)为有色固体,HAt不稳定,AgAt感光性很强,但不溶于水也不溶于稀酸;④锂(Li)在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱;⑤硫酸锶(SrSO4)是难溶于水的白色固体;⑥硒化氢(H2Se)是无色,有毒,比H2S稳定的气体。
A.①②③④ B.②④⑤ C.①③⑤ D.②④⑥
6.镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳,越来越成为人们研制绿色原电池的关注焦点。其中一种镁原电池的反应为:
 MgxMo3S4
x
Mg + Mo3S4
MgxMo3S4
x
Mg + Mo3S4
在镁原电池放电时,下列说法错误的是
A.Mg2+向正极迁移 B.正极反应为:Mo3S4 + 2xe- = Mo3S42x-
C.Mo3S4发生氧化反应 D.负极反应为:xMg-2xe- = xMg2+
5.有关键能数据如表:
晶体硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)=SiO2(s); = -989.2/kJ·mol-1,则X的值为
= -989.2/kJ·mol-1,则X的值为
A.423.3 B.460 C.1165.2 D.920
4.将下列每组内的四种物质同时加入到水中,充分搅拌后,既有氧化还原反应发生,又有沉淀产生的一组是(酸均过量)
A.Na2O2、NH4Cl、NaCl、Na2SO4 B.FeO、AlCl3、Na2SiO3、硝酸
C.KHCO3、Ca(OH)2、MgCl2 、硫酸 D.Na2CO3、BaCl2、K2S、盐酸
|
化学键 |
Si-O |
O=O |
Si-Si |
|
键能/kJ·mol-1 |
X |
498.8 |
176 |
3.一定量的铜与一定量的浓硝酸恰好完全反应,产生NO、NO2两种气体(不考虑2NO2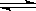 N2O4),已知反应中被还原的HNO3占HNO3总量的1/3,则还原产物中NO、NO2的物质的量之比为
N2O4),已知反应中被还原的HNO3占HNO3总量的1/3,则还原产物中NO、NO2的物质的量之比为
A.2∶1 B.1∶2 C.2∶3 D.1∶1
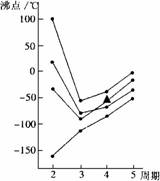
2.右图中每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化(外压为1atm),其中▲代表的是
A.AsH3 B.HBr C.H2Se D.GeH4
1. 不能用勒沙特列原理解释的是
不能用勒沙特列原理解释的是
A.经粉碎的黄铁矿在沸腾炉中燃烧得较快、较完全
B.饱和FeCl3溶液中加入盐酸,丁达尔效应减弱
C.NaOH溶液使酯水解比稀H2SO4使酯水解效果好
D.氨水的保存需要密封、低温保存
29.(6分) (1)Zn-2e- = Zn2+(1分); 2H++2e- = H2↑(1分)。
(2) (4分)
Zn+2H+ = Zn2++H2↑ - 转移2e-
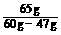 =
= 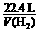 =
=
得V(H2) = 4.5 L; Q = 3.8×104 C。
附加题(10分,奥赛班必做,平行班选做)
(1)28.2 g(1分)。 (2)96.25%(1分)。 (3)71 g(1分)。
(4) KxOy+x/2CO2 = x/2K2CO3+(y-0.5x)/2O2
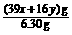 =
= 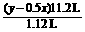
解得x:y=2:3,即n(K):n(O)=2:3。(合理即给分) (3分)
即得化学式为:n(KO2):n(K2O2) = 2:1(2分),n(KO2):n(K2O) = 4:1。(2分)
27(11分)
(1)除去铁锈表面的油污;促进Na2CO3水解,加快除去油污的速度(2分) (2)负极;浅绿色变成棕黄色 ;2Fe2++Cl2=2Fe3++2Cl-(3分)
(3) B (1分) (4)使铁屑完全溶解;抑制Fe3+的水解,保证产物的纯度 (2分) (5)NaOH溶液(或其他碱溶液) (1分) (6)A、D、C、B (2分)
28.(12分)
(1)2Al+6H+ = 2Al3++3H2↑或2Al+3Cu2+ = 2Al3++3Cu; (2分)
2Cu+O2+H2O+CO2 = Cu2(OH)2CO3。(2分)
(2)白色沉淀生成,后沉淀逐渐溶解至消失。 (2分)
Al3++3OH- = Al(OH)3↓,(1分)
Al(OH)3+OH- = AlO2- +2H2O。(1分)
(3)①3MnO2+4Al 3Mn+2Al2O3。 (2分)
3Mn+2Al2O3。 (2分)
②MnO2+H2O2+2H+ = Mn2++O2↑+2H2O。(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com