
题目列表(包括答案和解析)
18.(8分)某化学兴趣小组利用饱和氯水与石灰石的反应,制取较浓的HClO溶液,并对所得溶液中的部分阴离子进行检验。
|
|
实验操作 |
实验现象 |
|
步骤1 |
在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,过滤,将滤液分为若干份 |
有少量气泡产生,溶液的黄绿色褪去 |
|
步骤2 |
将第一份滤液与稀盐酸混合 |
产生大量气泡 |
|
步骤3 |
将第二份滤液加热 |
溶液变浑浊,且有大量无色气体产生 |
⑴步骤1过滤的目的是__________________________________________。
⑵步骤2、步骤3的实验目的都是 ;为达到该实验目的,还可以采取的方法是 。
⑶请你设计一个简单的实验方案,证明步骤1所得滤液中的HClO浓度比饱和氯水中HClO浓度大: 。
17.(7分)分别取40mL的0.50mol/L盐酸与0.55mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题。
(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式 ;
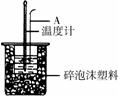 (2)如右图所示,仪器A的名称是_______________;在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的
(2)如右图所示,仪器A的名称是_______________;在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的 (填“偏大”、“偏小”或“无影响”);
(填“偏大”、“偏小”或“无影响”);
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容
c=4.18J/(g·℃)。为了计算中和热,实验时还需测量的数据有(填序号)
____ _____;
A.反应前盐酸溶液的温度 B.反应前盐酸溶液的质量
C.反应前氢氧化钠溶液的温度 D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度 F.反应后混合溶液的质量
(4)某学生实验记录数据如下:
|
实验序号 |
起始温度t1℃ |
终止温度t2℃ |
|
|
盐酸 |
氢氧化钠 |
混合溶液 |
|
|
1 |
20.0 |
20.1 |
23.2 |
|
2 |
20.2 |
20.4 |
23.4 |
|
3 |
20.5 |
20.6 |
23.6 |
依据该学生的实验数据计算,该实验测得的中和热 =_____________;
=_____________;
(5) (填“能”或“不能”)用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,理由是 。
16.(10分)六个未贴标签的试剂瓶中分别装有以下稀溶液①FeSO4、②H2SO4、③BaCl2、④H2O2、⑤Al(NO3)3及⑥NaOH。
(1)某同学想不用其它试剂,仅通过用试管取少量上述溶液进行两两混合实验而给试剂瓶贴上正确的标签,他能成功吗? (填“能”或“不能”)
(2)实验中发现,有一组在混合时,随着试剂滴加的顺序不同而出现明显不同的现象,该组是 ;有一组在混合时,随着试剂滴加后的时间不同而出现明显不同的现象,该组是 ,其中涉及氧化还原应的化学方程式为
(3)鉴别后,该同学又用FeSO4做了三个体现Fe2+还原性的实验,每次加入上述两种已鉴别的物质的溶液与其混合。试写出其中两个反应的离子方程式 。
(4)实际上实验室配制的FeSO4溶液不可长期保存,短期保存时可在FeSO4溶液配制时加入少量的上述 (填编号)防止水解,若能再加上 (填物质名称)效果会更好。实验室由FeSO4溶液得到晶体的实验操作为 ,为了提高硫酸亚铁晶体在空气中的稳定性,实验时常在FeSO4溶液中加入一定量的(NH4)2SO4晶体,试分析(NH4)2SO4提高FeSO4在空气中稳定性的原因 。
15.往含I-和Cl-的稀溶液中滴人AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如右图所示。则原溶液中c(I-)/c(Cl-)的比值为
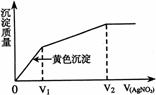
A (V2-V1)/V1 B V1/V2
C V1/(V2-V1) D V2/V1
第Ⅱ卷 非选择题(共55分)
14.有 ① Na2CO3溶液 ② CH3COONa溶液 ③ NaOH溶液各25mL,物质的量浓度均为0.1mol·L-1,下列说法正确的是
A.3种溶液pH的大小顺序是 ③>②>①
B.若将3种溶液稀释相同倍数,pH变化最大的是②
C.若分别加入25mL0.1mol·L-1盐酸后,pH最大的是①
D.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②
13.草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
A.V(NaOH)== 0时,c(H+)== 1 × 10-2 mol/L
B.V(NaOH)< 10 mL时,不可能存在c(Na+)== 2 c(C2O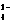 )+ c(HC2O
)+ c(HC2O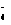 )
)
C.V(NaOH)== 10 mL时,c(H+)== 1 × 10-7mol/L
D.V(NaOH)> 10 mL时,c(Na+)> c(C2O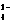 )>c(HC2O
)>c(HC2O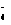 )
)
12.氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是
A.再通入少量氯气,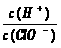 减小 B.通入少量SO2,溶液漂白性增强
减小 B.通入少量SO2,溶液漂白性增强
C.加入少量固体NaOH,一定有c(Na+)=c(Cl-)+c(ClO-)
D.加入少量水,水的电离平衡向正反应方向移动
11.有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数)。下列说法正确的是
A.若X(OH)n为强碱,则Y(OH)n也一定为强碱
B.若HnXOm为强酸,则X的氢化物溶于水一定显酸性
C.若X元素形成的单质是X2,则Y元素形成的单质一定是Y2
D.若Y的最高正价为+m,则X的最高正价一定为+m
10.某学生设计了一个"黑笔写红字"的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是
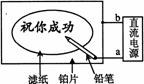
A 铅笔端作阳极,发生还原反应
B 铂片端作阴极,发生氧化反应
C 铅笔端有少量的氯气产生
D a点是负极,b点是正极
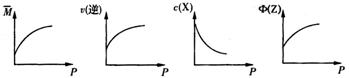
9. 在一固定体积的密闭容器中,充入3mo1X和1molY,发生如下反应:3X(g)+Y(g)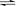 aZ(g),平衡后,Z的体积分数为b%,若维持容器容积和温度不变,1.2molX、0.4molY和1.2molZ为起始物质,达到平衡后,Z的体积分数也为b%。平衡后若缩小容器体积,混合气体平均相对分子质量
aZ(g),平衡后,Z的体积分数为b%,若维持容器容积和温度不变,1.2molX、0.4molY和1.2molZ为起始物质,达到平衡后,Z的体积分数也为b%。平衡后若缩小容器体积,混合气体平均相对分子质量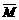 、逆反应速率v(逆),X的浓度c(X)和Z的体积分数Φ(Z),随压强(P)的变化,一定符合的是
、逆反应速率v(逆),X的浓度c(X)和Z的体积分数Φ(Z),随压强(P)的变化,一定符合的是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com