
题目列表(包括答案和解析)
6. 下列事实不能用勒沙特列原理解释的是:
A. 氨水应密闭保存,放置低温处
B. 在FeSO4溶液中,加入Fe粉以防止变质
C. 打开汽水瓶,看到有大量的气泡逸出
D. 实验室常用排饱和食盐水的方法收集Cl2
5.对于某一已达化学平衡状态的可逆反应,如果改变某种条件,结果使某生成物的浓度增大,则
A.平衡一定向正反应方向移动 B.平衡一定向逆反应方向移动
C.反应物的浓度相应减小 D.平衡可能移动也可能不移动
4、下列化学式能真实表示物质分子组成的是
A.NaOH B.S03 C.CsCl D.Si02
3.下列各组物质在不同条件下反应时,均能得到不同产物,其中主要是由温度不同而引起的是
①Na+O2 ②P+ Cl2 ③ C2H5OH+ H2SO4 (浓) ④Cu+HNO3 ⑤CO2+NaOH ⑥C2H2+HCl ⑦Fe+ H2SO4 ⑧Cl2+NaOH
A.①③⑧ B.②⑤⑦ C.③④⑧ D.②③⑥
2.下列各物质中,所有原子都满足最外层为8电子结构的是
A.BeCl2 B.PCl3 C.PCl5 D.NH3
1.从硫元素的化合价态上判断,下列物质中的硫元素不能表现氧化性的是
A.Na2S B. S C.SO2 D. H2SO4
22、(7分)某草酸亚铁样品(FeC2O4·xH2O)中含有少量硫酸亚铁。现用滴定法测定该样品中FeC2O4的含量。滴定反应是: 5 Fe2+ +5C2O42-+3MnO4-+24H+==5 Fe3+ +10CO2↑+3Mn2++12H2O
实验方案设计为:
①将准确称量的a g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为b mL
②向上述滴定混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5-8min,经检验溶液合格后,继续用0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为c mL
③ 。
④数据处理。 请回答下列问题:
(1)上述实验方案中的步骤③是 。
(2)洁净的滴定管在滴定前必须进行的操作是:
Ⅰ、检验活塞是否漏水。
Ⅱ、 。
Ⅲ、加入高锰酸钾标准溶液,赶走尖嘴部位的气泡,调节起始读数。
(3)步骤②中检验溶液是否合格的操作是:取1滴煮沸后的溶液滴入装有 溶液的试管中,如 ,则说明溶液合格。
(4)某小组的一次测定数据记录如下:
|
a/g |
起始读数/mL |
b/mL |
c/mL |
|
0.1970 |
0.00 |
31.30 |
42.40 |
根据数据计算0.1970g 样品中:n(Fe2+)== ; n(C2O42-)== ;
FeC2O4 的质量分数为 (精确到0.01%)
2007-2008学年度上学期崇仁一中高三第五次月考
21. (7分)(1)在甲、乙两容器中分别发生反应2SO2(g)+O2(g)
2SO3(g);△H<0,甲恒容、乙恒压,温度相同且恒定。起始时甲中加入0.02molSO2和0.01molO2,乙中加入0.02molSO3气体,开始时两容器压强相等,最后分别达到平衡。
(7分)(1)在甲、乙两容器中分别发生反应2SO2(g)+O2(g)
2SO3(g);△H<0,甲恒容、乙恒压,温度相同且恒定。起始时甲中加入0.02molSO2和0.01molO2,乙中加入0.02molSO3气体,开始时两容器压强相等,最后分别达到平衡。
下列有关它们达到平衡状态后的叙述正确的是 (填序号)。
A.体积:甲可能小于乙 B.SO3的物质的量:甲一定小于乙
C.压强:甲可能大于乙 D.浓度比c(SO2)/c(SO3):甲一定小于乙
(2)丙容器为容积不变的反应容器,要求通过调节体系的温度使反应
 2SO2(g)+O2(g)
2SO3(g);△H<0达到平衡时,保持容器内气体总物质的量为12mol。现向容器中加主xmolSO2,6.5mol O2,2.0molSO3。
2SO2(g)+O2(g)
2SO3(g);△H<0达到平衡时,保持容器内气体总物质的量为12mol。现向容器中加主xmolSO2,6.5mol O2,2.0molSO3。
①若x=5.5,需要 (填“降低”“升高”或“保持”)体系温度,使反应在平衡时达到题设要求; ②欲使起始反应维持向逆反应方向移动,则x的取值范围为 。
(3)一定条件下,将合成氨反应放在一带活塞的密闭容器中进行,达平衡后,四次改变条件(达到四个新的平衡状态Ⅰ、Ⅱ、Ⅲ、Ⅳ,每次均只改变一个条件),对正逆反应的速率的影响如下图。则改变的四个条件依次为:
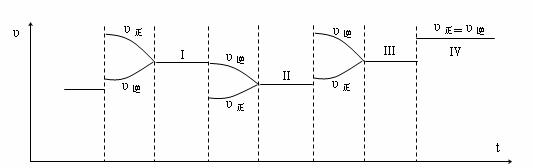
Ⅰ、 Ⅱ、 Ⅲ、 Ⅳ、
20.(8分)下图是一些常见元素的单质或化合物之间的转化关系。溶液中的水以及部分反应物或生成物未标出。A、E是空气中的两种主要成分,C是由两种元素组成的新型材料,且和SiC具有相同的价电子数和原子数,J是一种能引起温室效应的气体,K是两性化合物。反应③、④、⑤用于工业中生产H。
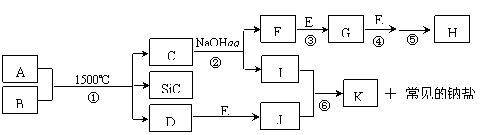
回答下列问题:
⑴ 写出下列物质的化学式:F ,I ;
⑵ 写出反应③的化学方程式: ;
⑶ 写出反应⑥的离子方程式: ;
⑷ B和SiC的纳米级复合粉末是新一代大规模集成电路理想的散热材料。反应①是科学家研究开发制备该纳米级复合粉末的最新途径。已知B由Si及另外两种元素组成,且Si与另外两种元素的物质的量之比均为1∶4,写出反应①的化学方程式: 。
19.(8分)现有常温下0.1 mol·L-1的纯碱溶液。
(1)下列纯碱溶液中离子浓度之间的关系正确的是 。
A.C(H+)+ C(Na+)= C(OH-)+ C(HCO3-)+2 C(CO32-) B.C(OH-)= C(H+)+ C(HCO3-)+2 C(H2CO3)
C.C(Na+)=2{ C(CO32-)+ C(HCO3-)+ C(H2CO3)} D.C(CO32-)= C(HCO3-)+ C(H2CO3)
(2)纯碱溶液呈碱性,其原因是(用离子方程式表示) ,验证纯碱溶液呈碱性的实验方法(简述操作过程): 。
(3)纯碱溶液与氯化铝溶液混合有大量泡沫生成,其原因是(用离子方程式表示)
(4)某同学认为纯碱溶液中Na2CO3的水解是微弱的,发生水解的CO32-不超过其总量的10%。请你设计实验证明该同学的观点是否正确。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com