
题目列表(包括答案和解析)
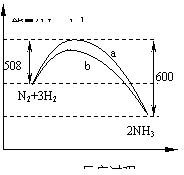
14.右图是198K时N2与H2反应过程中能量变化的( )
曲线图。下列叙述正确的是
A.该反应的热化学方程式为:
N2+3H2  2NH3,△H=-92kJ·mol-1
2NH3,△H=-92kJ·mol-1
B.b曲线是加入正催化剂时的能量变化曲线
C.加入催化剂,该化学反应的反应热改变
D.在温度体积一定的条件下,通入1molN2和3molH2反应后放出的热 量为Q1kJ,若通入2 molN2和6 molH2反应后放出的热量为Q2kJ则184>Q2 >2Q1
13.下列离子方程式错误的是: ( )
A.向NH4HSO4的稀溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全:
NH4+ + H+ + SO42- + Ba2+ + 2OH- = NH3·H2O + BaSO4↓+ H2O
B.酸性高锰酸钾溶液与H2O2溶液混合:2MnO4-+3H2O2+6H+=2Mn2++6H2O+O2↑
C.向碳酸氢钙溶液中滴入少量澄清石灰水:
Ca2+ +HCO3- + OH- = CaCO3↓ +H2O
 D.向氨水中通入少量的二氧化硫气体:
D.向氨水中通入少量的二氧化硫气体:
2NH3·H2O +SO2=2NH4++SO32- +H2O
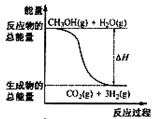
12.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g); △H= + 49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9 kJ·mol-1
下列说法正确的是 ( )
A.CH3OH的燃烧热为192.9 kJ·mol-1
B.反应①中的能量变化如右图所示
C.据盖斯定律和反应①和②可确定通常情况下氢气的燃烧热
D.根据②推知反应: CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ·mol-1
11.水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+xOH- Fe3O4+S4O62-+2H2O,下列说法中,正确的是 ( )
A.每生成1mol Fe3O4,反应转移的电子总数为2mol
B.Fe2+和S2O32-都是还原剂
C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol
 D.x=2
D.x=2
10.最新研制出一种由甲醇和氧气以及强碱作电解质溶液的新型电池,它具有体积小、能量大、使用方便、不污染环境等优点。下列有关此电池的叙述错误的是 ( )
A.正极电极反应:O2+2H2O+4e-===4OH-
B.负极电极反应:CH3OH+8OH--6e-===CO32-+6H2O
C.电池在使用过程中电解质溶液的pH升高
D.当外电路通过0.6 mol电子时,理论上消耗甲醇3.2 g
9.某无色溶液与NH4HCO3作用能产生气体,此溶液中可能大量共存的离子组是 ( )
A.Cl-、Mg2+、H+、Cu2+、SO42-
B.Na+、Ba2+、NO3-、H+、Cl-
C.MnO-4、Fe2+、Cl-、H+、SO42-
D.K+、NO3-、SO42-、OH-、Na+
8.设NA为阿伏加德罗常数的值,下列叙述中不正确的是 ( )
①12.4g白磷晶体中含有的P-P键数是0.6NA (P4式量为124)
②电解精炼铜时转移了NA个电子,阳极溶解32 g铜
③100g的98%的浓H2SO4中所含的氧原子数为4NA
④2mol SO2和1 mol O2混合在V2O5存在的条件下于密闭容器中加热反应后,容器内物质
分子数大于2NA
⑤2.9g 2CaSO4·H2O含有的结晶水分子数为0.02NA (2CaSO4·H2O式量为290)
⑥含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA
A.②③⑤⑥ B.①③④⑤⑥ C.①②③④⑤ D.③④⑤⑥
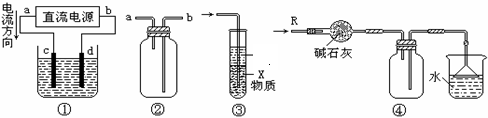
7.关于下列各装置图的叙述中,不正确的是 ( )
A.装置①中,d为阳极、c为阴极
B.装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
6.2005年美国《Science》上发表论文,宣布发现了一种Al的超原子结构,这种超原子(Al13)是以1个Al原子在中心,12个Al原子在表面形成的三角二十面体结构。这种超原子具有40个价电子时最稳定。请预测稳定的Al13所带的电荷为 ( )
A.+3 B.+2 C.0 D.-1
5.某溶液中含有Na+、NH4+、HCO3-、CO32-、SO32-..CH3COO-等6种离子。若向其中加入足量Na2O2后,溶液中离子浓度基本保持不变的是 ( )
A. CH3COO- B.Na+ C.CO32- D.SO32-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com