
题目列表(包括答案和解析)
23.(6分)下图中A、B、C、D、E、F、G均为有机化合物。
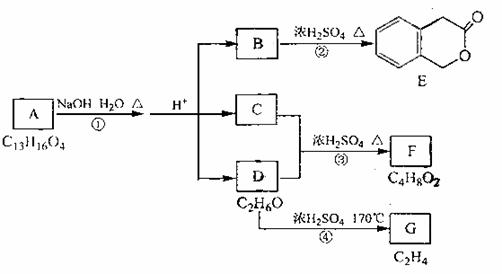
根据上图回答问题:
(1)B的分子式是 ▲ ,A的结构简式是 ▲ ,反应①的反应类型是 ▲ ;
(2)符合下列3个条件的B的同分异构体的数目有 ▲ 个。
i)含有邻二取代苯环结构、ii)与B有相同官能团、iii)不与FeCl3溶液发生显色反应。
写出其中任意一个同分异构体的结构简式 ▲ ;
(3)G是重要的工业原料,用化学方程式表示G的一种重要的工业用途 ▲ 。
22.(6分)克矽平是一种治疗矽肺病的药物,其合成路线如下(反应均在一定条件下进行):

试回答下列问题:
 (1)化合物Ⅰ的某些性质类似苯。例如,化合物Ⅰ可以一定条件下与氢气发生加成反应
(1)化合物Ⅰ的某些性质类似苯。例如,化合物Ⅰ可以一定条件下与氢气发生加成反应
生成 ,其反应方程式为 ▲ (不要求标出反应条件);
(2)化合物I生成化合物Ⅱ是原子利用率100%的反应,所需另一种反应物的分子式为
▲ ;
(3)下列关于化合物Ⅱ和化合物Ⅲ的化学性质,说法正确的是 ▲ (填字母);
A.化合物Ⅱ可以与CH3COOH发生酯化反应
B.化合物Ⅱ不可以与金属钠生成氢气
C.化合物Ⅲ可以使溴的四氯化碳溶液褪色
D.化合物Ⅲ不可以使酸性高锰酸钾溶液褪色
(4)化合物Ⅲ生成化合物Ⅳ的反应方程式为 ▲ (不要求标出反应条件);
(5)用氧化剂氧化化合物Ⅳ生成克矽平和水,则该氧化剂为 ▲ 。
21.(10分)间接碘量法测定胆矾中铜含量的原理和方法如下:
已知:在弱酸性条件下,胆矾中Cu2+与I-作用定量析出I2,I2溶于过量的KI溶液中:
I2 + I-==I3-,又知氧化性:Fe3+ > Cu2+ > I2 > FeF63-;析出I2可用cmol/LNa2S2O3标准溶液滴定:2S2O32- + I3- ==S4O62- + 3I-。
操作:准确称取ag胆矾试样(可能含少量 Fe2(SO4)3),置于250mL碘量瓶(带磨口塞的锥形瓶)中,加50mL蒸馏水、5mL3mol/LH2SO4溶液,加少量NaF,再加入足量的10%KI溶液,摇匀。盖上碘量瓶瓶盖,置于暗处5min,充分反应后,加入1~2mL0.5%的淀粉溶液,用Na2S2O3标准溶液滴定到蓝色褪去时,共用去VmL标准液。
(1)实验中,在加KI前需加入少量NaF,推测其作用可能是 ▲ ;
(2)实验中加入硫酸,你认为硫酸的作用是 ▲ ;
(3)本实验中用碘量瓶而不用普通锥形瓶是因为 ▲ ;
(4)硫酸铜溶液与碘化钾溶液反应生成白色沉淀(碘化亚铜)并析出碘,该反应的离子方程式为 ▲ ;
(5)根据本次实验结果,该胆矾试样中铜元素的质量分数ω(Cu)= ▲ 。
20.(6分)可用于分离或提纯物质的方法有:A、分馏 B、盐析 C、过滤 D、重结晶 E、升华 F、渗析 G、电解 H、加热分解 I、蒸馏 J、灼热氧化。如欲分离或提纯下列各组混合物,请选择上述方法中最合适者(填相应字母)填空:
(1)从石油中分离出汽油和煤油等成分 ▲ ;
(2)除去淀粉溶液中的少量碘化钠 ▲ ;
(3)从油脂皂化反应后的混合液中分离出高级脂肪酸钠 ▲ ;
(4)除去粗铜中锌、银等金属 ▲ ;
(5)除去水中的Na+、SO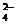 、Cl-等杂质 ▲ ;
、Cl-等杂质 ▲ ;
(6)除去KNO3晶体中混有的少量NaCl ▲ 。
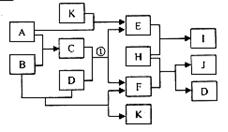
19.(6分)右图中各物质均由常见元素(原子序数
≤20)组成。已知A、B、K为单质,且在常温
下A和K为气体,B为固体。D为常见的无色
液体。I是一种常用的化肥,在其水溶液中滴加
AgNO3溶液有不溶于稀HNO3的白色沉淀产生。J是一种实验室常用的干燥剂。它们的相互转化关系如右图所示(图中反应条件未列出)。请回答下列问题:
(1)I的化学式为 ▲ ,J的电子式为 ▲ ;
(2)反应①的化学方程式为 ▲ ;
(3)F的水溶液与氯气反应的离子方程式为 ▲ 。
17.(8分)2gCu2S 和CuS 的混合物在酸性溶液中用400mL0.075mol /L KMnO 4溶液处理,发生反应如下:8MnO 4-+5 Cu2S+44H+=10Cu 2++5SO 2+8Mn 2++22H2O;
6MnO 4-+5 CuS+28H+=5 Cu 2++5SO 2+6Mn 2++14H2O。反应后煮沸溶液,赶尽SO2,剩余的KMnO 4恰好与350mL0.1mol/L(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
 MnO 4-+ Fe2+ + H+= Mn2++ Fe3++ H2O;
MnO 4-+ Fe2+ + H+= Mn2++ Fe3++ H2O;
(2)KMnO 4溶液与混合物反应后,剩余KMnO 4的物质的量为 ▲ mol;
(3)欲配制500mL0.1 mol /L Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的质量为 ▲ g;
(4)混合物中Cu2S的质量分数为 ▲ 。
 18.(6分)元素周期表反映了元素性质的周期性变化规律,请根据短周期元素在周期表中的位置、结构和相关性质并结合提供图表,回答下列问题:
18.(6分)元素周期表反映了元素性质的周期性变化规律,请根据短周期元素在周期表中的位置、结构和相关性质并结合提供图表,回答下列问题:
(1)短周期元素中,原子的最外层电子数与电子层数相等的元素有 ▲ 种。
(2)第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如上表所示,则A的晶体类型是 ▲ ,C与D发生反应的化学方程式为 ▲ 。
(3)第三周期元素单质的熔点变化如图I所示,则g元素的名称为 ▲ ,写出工业上冶炼h的化学方程式 ▲ 。
 (4)分子甲和离子乙含有相等的电子数,且乙的立体结构如图II所示。写出甲、乙反应的离子方程式
▲
。
(4)分子甲和离子乙含有相等的电子数,且乙的立体结构如图II所示。写出甲、乙反应的离子方程式
▲
。
16.在恒温恒容的密闭容器中,发生反应3A(g)+B(g)  xC(g)。
xC(g)。
Ⅰ、将3molA和2molB在一定条件下反应,达平衡时C的体积分数为a;
Ⅱ、若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。
下列说法正确的是
① 若Ⅰ达平衡时,A、B、C各增加1mol,则B的转化率将一定增大
② 若向Ⅰ平衡体系中再加入3molA和2molB,C的体积分数若大于a,可断定x>4
③ 若x=2,则Ⅱ体系起始物质的量应当满足3 n(B) =n(A)+3
④ 若Ⅱ体系起始物质的量当满足3 n(C) +8n(A)==12 n(B)时,可断定x=4
A.①② B.①④ C.②③ D.③④
第Ⅱ卷(非选择题 共60分)
15.新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化。某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式如下:
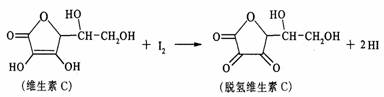
下列说法正确的是
A.上述反应为取代反应 B.维生素C在酸性条件下水解只得到1种产物
C.维生素C不溶于水,可溶于有机溶剂 D.维生素C的分子式为C6H10O6
14.下列变化或数据与氢键无关的是
A.SbH3的沸点比PH3高
B.氨分子与水分子形成一水合氨
C.甲酸蒸气的密度在373K时为1.335g·L-1,在293K时为2.5 g·L-1
D.丙酮在己烷和三氟甲烷中易溶解,其中在三氟甲烷中溶解时的热效应较大
13.对于某些离子的检验及结论一定正确的是
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32-
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42-
C.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com