
题目列表(包括答案和解析)
1.法新社2006年4月4日报道,天文学家在太空中发现一个长4630亿千米的甲醇气团,
这一天文发现为揭示“原始气体如何形成巨大恒星”提供了有力依据。下列有关甲醇的说法正确的是
A.甲醇能使蛋白质变性 B.甲醇能发生消去反应
C.甲醇不能被催化氧化 D.甲醇与钠反应比水与钠反应剧烈
27.(10分)2gCu2S和CuS的混合物在酸性溶液中用400 mL0.075mol·L-1 KMnO4溶液处理,发生反应如下:
8MnO4- + 5 Cu2S + 44 H+=10Cu2+ + 5SO2 + 8Mn2+ + 22H2O
6MnO 4- + 5 CuS +28H+=5Cu2+ + 5SO2 + 6Mn2+ + 14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350mL0.1mol/L(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
MnO4- + Fe2+ + H+ = Mn 2+ + Fe3+ + H2O
(2)KMnO4溶液与混合物反应后,剩余 KMnO 4的物质的量为 mol。
(3)欲配制500mL0.1mol·L-1 Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M = 392g/mol)的质量为
g。
(4)混合物中Cu2S的质量分数为 。
26.(13分)(1)在饱和氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,同时还产生的现象有
① ② 。
用离子方程式表示产生上述现象的原因____________________ 。
(2)在饱和氯化铁溶液中加入一种单质,也会产生类似上述现象的反应,这种单质是( )
A.磷 B.硫 C.镁 D.铜
(3)向物质的量之和为0.1mol 的FeCl3和AlCl3混合溶液中加入90mL 4mol/L的NaOH溶液,使其充分反应。假设原溶液中Al3+ 物质的量与Al3+和Fe3+总物质的量之比为X。
①当X=0.4时,溶液中产生的沉淀是 ,其物质的量为 。
②当沉淀只有Fe(OH)3时,X的取值范围为
25.(11分)6、已知B、C为常见的两种金属单质,E、I为常见的两种非金属单质,反应②为D的浓溶液与C在加热条件下的反应。P溶液和G溶液中具有相同的阳离子。请根据要求回答下列问题:
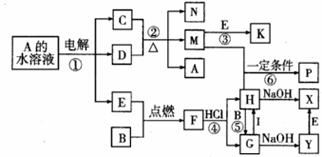
(1)写出I的化学式 。
(2)写出反应①中阴极发生的电极反应式
,
写出反应①的化学方程式
。
(3)写出反应④的离子方程式
,
写出反应⑤的离子方程式
,
写出反应⑥的离子方程式
。
24.(14分)某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
|
实验步骤 |
实验现象 |
|
将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中 |
产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
|
反应结束后分离出溶液备用 |
|
|
红色固体用蒸馏水洗涤后,置于潮湿空气中 |
一段时间后固体由红色变为绿色[视其主要成分为[Cu2(OH)2CO3] |
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应: ;
化合反应: 。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可观察到的现象是_________________________________________。解释此现象的离子方程式是_____________________________________________________________________________。
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来冶炼金属锰。
①用铝与软锰矿冶炼锰的原理是(用化学方程式表示) 。
②MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是______________________________________。
23.(12分)某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-等,取该溶液进行如下实验:
①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇到空气立即变为红棕色;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤取实验④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。
请回答下列问题:
⑴在实验①中,下图所示的操作中正确的是___________(填代号)
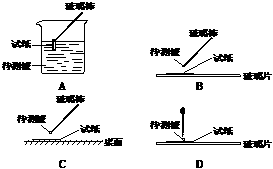
⑵根据上述实验判断原溶液中肯定存在的离子是______________,肯定不存在的离子是_____________
⑶写出与②③④三个实验有关的离子方程式:
②: ___ ___________ _____ _______ ;③: _ ______ ________________ ;
④: ___ ______ ___________ _____
22.(10分)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
(1)定性分析:如图甲可通过观察 ,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3 更为合理,其理由是 。写出H2O2在二氧化锰作用下发生反应的化学方程式 。
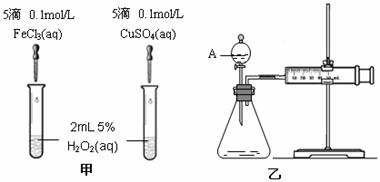
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。图中仪器A的名称为 ,(1分)检查该装置气密性的方法是
,实验中需要测量的数据是 。(1分)
21.(10分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
NO3-+4H++3e→NO+2H2O
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式
(2)反应中硝酸体现了 、 性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是 mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:
。
20.MnO2和Zn是制造干电池的重要原料,工业上用软锰矿和闪锌矿联合生产MnO2和Zn的基本步骤为:
⑴ 软锰矿、闪锌矿与硫酸共热: MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O。
 ⑵ 除去反应混合物中的不溶物
⑵ 除去反应混合物中的不溶物
⑶ 电解混合液MnSO4+ZnSO4+2H2O MnO2+Zn+2H2SO4
下列说法不正确的是
A.步骤⑴中MnO2和H2SO4都是氧化剂
B.步骤⑴中每析出12.8g S沉淀共转移0.8mol电子
C.电解时MnO2在阳极处产生
D.硫酸在生产中可循环使用
第II卷(非选择题,共80分)
19.已知反应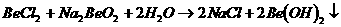 能完全进行,则下列推断中,正确的是
能完全进行,则下列推断中,正确的是
A.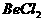 溶液的pH<7,将其蒸干并灼烧后,得到的残留物可能为BeO
溶液的pH<7,将其蒸干并灼烧后,得到的残留物可能为BeO
B.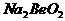 溶液的pH>7,将其蒸干并灼烧后,得到的残留物可能为BeO
溶液的pH>7,将其蒸干并灼烧后,得到的残留物可能为BeO
C.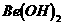 既能溶于盐酸又能溶于烧碱溶液
既能溶于盐酸又能溶于烧碱溶液
D.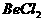 水溶液的导电性强,因此
水溶液的导电性强,因此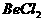 一定是离子化合物
一定是离子化合物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com