
题目列表(包括答案和解析)
4.某温度下,重水(D2O)的离子积常数为1.6×10-15 若用定义pH一样来规定pD=-lg[D+ ],则在该温度下,下列叙述正确的是( )。
A.纯净的重水中,pD=7
B.1 L溶解有0.01 mol DC1的重水溶液,其pD=2
C.1 L溶解有0.01 mol NaOD的重水溶液,其pD=12
D.纯净的重水中, [D+ ][OD- ]>1.0×10-1 4
3.下列现象或应用中,不涉及胶体性质的是
A. 在饱和的氯化铁溶液中逐滴加入NaOH溶液,产生红褐色沉淀
B. 清晨,在茂密的树林中,常常可以看到从枝叶间透过的道道光柱
C.用半透膜分离淀粉和食盐的混合液
D.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
2.下列说法正确的是:
A.H与D,16O2与18O2互为同位素
B.H216O、D216O、H218O、D218O互为同素异形体
C.在NaCl晶体中,每个氯离子周围都有8个钠离子
D.L层电子为奇数的所有短周期元素所在族的序数与该元素原子的L层电子数相等
1.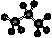 下列化学用语表达正确的是
下列化学用语表达正确的是
A.丙烷的分子结构模型示意图:
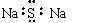 B.Na2S的电子式:
B.Na2S的电子式:
C.丙烯的结构简式:CH3CH2CH2
D.氢硫酸的电离方程式:H2S+H2O=H3O++HS-
已知:⑴ 凡与醛基直接相连的碳原子上的氢称为α一H原子,在稀碱溶液的催化作用下,一个醛分子上的α一H原子连接到另一个醛分子的氧原子上,其余部分连接到羰基碳原子上生成羟基醛,如:
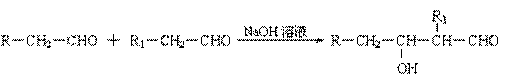
 ⑵
⑵
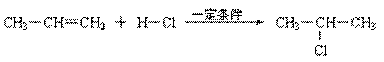
⑶合成路线如下:
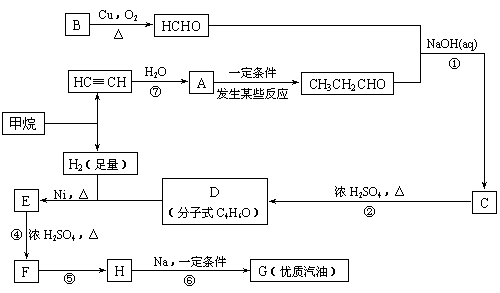
(1)写出D的结构简式
(2)在反应②-⑦中,属于加成反应的是 ,属于消去反应的是 。
(3)写出反应方程式
E → F: ;
(4)H也能与NaOH水溶液反应,其反应方程式为
。
28(B)(10分)下表是元素周期表中第一、第二周期10种元素的某种性质的一组数据(所列数据的单位是相同的)。除带“……”的四种元素除外,其余元素都给出了该种元素的全部该类数据。
|
(H) 13.6 |
|
|
|
|
|
|
(He) 24.6 54.4 |
|
(Li) 5.4 75.6 122.5 |
(Be) 9.3 18.2 153.9 217.7 |
(B) 8.3 25.2 37.9 259.4 340.2 |
(C) 11.3 24.4 47.9 64.5 392.1 489.9 |
(N) 14.5 29.6 47.4 72.5 97.9 552.1 …… |
(O) 13.6 35.1 …… …… …… …… …… …… |
(F) 17.4 34.9 …… …… …… …… …… …… …… |
(Ne) 21.6 41.6 …… …… …… …… …… …… …… …… |
研究这些数据:
(1)每组数据可能是该元素的________________
A.原子得到电子所放出的能量 B.原子半径的大小
C.原子逐个失去电子所吸收的能量 D.原子及形成不同分子的半径的大小
(2)分析同周期自左往右各元素原子的第一个数据
①总体变化趋势是_______(填“增大”或“减小”),②与前后元素相比,由于该元素的数值增大得较多而变为反常的元素是在________族,分析它们的原子核外电子排布后,指出造成上述反常情况的可能原因是_________________
A.它们的原子半径突然变小些 B.它们的核外电子排布处于饱和状态
C.它们的原子半径突然变大些 D.它们的核外电子排布处于半充满或全充满状态
根据以上规律,请推测镁和铝的第一个数据的大小Mg(1)_____Al(1)
(3)同一元素原子的一组数据是约以倍比关系增大,请你说出可能的一个原因是_________________________________________________,每个元素的一组数据中个别地方增大的比例特别大,形成突跃(大幅度增大),请找出这些数据,并根据这些数据出现的规律,你认为氧元素出现该情况的数据应该是氧元素8个数据的第_______个。
上述规律可以证明原子结构中_______________________________的结论。
27、 下图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去)。
下图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去)。
已知:E为红色固体,K为浅绿色溶液;反应②是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H常温下是气态; F、P 和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G分子构型为三角锥形,化合物M由两种元素组成,分子内共有58个电子。
(1)化合物A中含有的两种元素是 。
(2)F的化学式 ;G的水溶液中,最多的阳离子是 。
(3)写出K与H反应的离子方程式: 。
(4)在实验室中,向饱和H水溶液中加入CaCO3粉末,充分反应后过滤,可制得浓度较大的P的水溶液。使用化学平衡移动原理加以解释
。
26、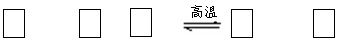 (14分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
(14分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
SiO2 + C+ N2 Si3N4 + CO
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应的氧化剂是 ,其还原产物是 ;
(3)该反应的平衡常数表达式为K= ;
(4)若知上述反应为放热反应,则其反应热△H 0(填“>”、“<”或“=”);升高温度,其平衡常数值 (填“增大”、“减小”或“不变”);
(5)若使压强增大,则上述平衡向 反应方向移动(填“正”或“逆”);
(6)若已知CO生成速率为v(CO)=18mol/(L.min),
则N2消耗速速率为v(N2)= mol/(L.min)。
25、(10分)2007年诺贝尔化学奖授予德国科学家格哈德·埃特尔,以表彰他在表面化学研究领域作出的开拓性贡献。
 (1)某校化学研究性学习小组的同学在技术人员的指导下,按下列
(1)某校化学研究性学习小组的同学在技术人员的指导下,按下列
流程探究不同催化剂对NH3还原NO反应的催化性能。
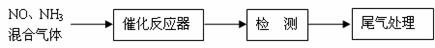
若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,
将经催化反应后的混合气体通过滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。为比较不同催化剂的催化性能,需要测量并记录的数据是 。
(2)在汽车的排气管上安装“催化转化器”(用铂、钯合金作催化剂),它的作用是使CO、NO反应生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧。
①写出CO与NO反应的化学方程式: ,该反应作氧化剂的物质是_________。
②用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g); ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g); ΔH2
若1mol CH4还原NO2至N2,整个过程中放出的热量为867kJ,则ΔH2= 。
(3)有人认为:该研究可以使氨的合成反应,在铁催化剂表面进行时的效率大大提高,从而使原料的转化率大大提高。请你应用化学基本理论对此观点进行评价:
。
24、(8分)在一定量的石灰乳中通入一定量的氯气,二者
恰好完全反应(发生的反应均为放热反应)。生成物中
含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、
C1O3-两种离子的物质的量(n)与反应时间(t)的曲
线如右图所示。
(1)t2时,Ca(OH)2与Cl2发生反应的总的化学方程式为
__________________________________________。
(2)该石灰乳中含有Ca(OH)2的物质的量是___________________ mol。
(3)据分析,生成Ca(C1O3)2的反应是由温度升高引起的,通入氯气的速度不同,C1O-和C1O3-的比例也不同。
若在原石灰乳中通入氯气的速度加快,则反应后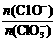 2(填“>”、“<”或“=”);
2(填“>”、“<”或“=”);
若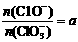 ,则n(C1-)= mol(用含a的代数式来表示)。
,则n(C1-)= mol(用含a的代数式来表示)。
23、(10分)KMnO4溶液常用做氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此精确配制KMnO4标准溶液的操作是:
(1)称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸l h;
(2)用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;
(3)过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处:
(4)利用氧化还原滴定方法,在70℃-80℃条件下用基准试剂(纯度高、稳定性好的物质)溶液测定其浓度。
回答下列问题:
(1)为什么要称取稍多于所需的KMnO4固体?___________________________
(2)为什么不用普通滤纸过滤器过滤?__________________________________
(3)如何保证在70℃-80℃条件下进行滴定操作:_______________________
(4)下列物质中,可以用于测定KMnO4溶液浓度的基准试剂是_____________
A.H2C2O4·2H2O B.FeSO4·7H2O C.浓盐酸 D.Na2SO3
(5)若准确称取W g草酸晶体(H2C2O4·2H2O)溶于水配成500 mL水溶液,取25.00 mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,消耗高锰酸钾溶液V mL。
6H++2MnO4-+5H2C2O4·2H2O====2Mn2++10CO2↑+18H2O,问:
①滴定时,高锰酸钾溶液应装在_____ ___________;
②滴定终点标志是_____________ _____;
③KMnO4溶液的物质的量浓度为____ ______________:
④若滴定前平视,滴定后俯视,则测得的浓度值将_____ ___(填“偏高”或偏低)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com