
题目列表(包括答案和解析)
18.T℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是
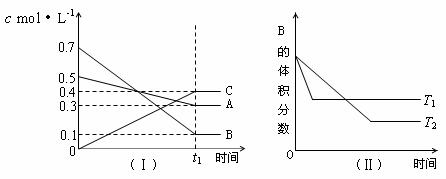
A.在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动
B.(t1+10)min时,保持容器体积不变,通入稀有气体,平衡向逆反应方向移动
C.T℃时,在相同容器中,若由0.3mol·L-1 A、0.1 mol·L-1 B和0.4 mol·L-1 C反应,达到平衡后,C的浓度仍为0.4 mol·L-1
D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
17.将一定质量的镁和铝的混合物投入100 mL盐酸中,固体全部溶解后,向所得溶液中
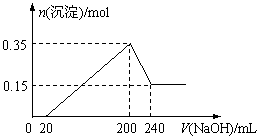 加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。若不考虑金属和盐酸反应时HCl的挥发,则下列
加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。若不考虑金属和盐酸反应时HCl的挥发,则下列
说法正确的是
A.镁和铝的总质量为9 g
B.盐酸的物质的量浓度为5 mol·L-1
C.NaOH溶液的物质的量浓度为5 mol·L-1
D.生成的氢气在标准状况下的体积为11.2 L
16.关于某无色溶液中所含离子的鉴别,下列判断正确的是
A.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有Cl-存在
B.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有SO42-存在
C.通入Cl2后,溶液变为黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在
D.加入盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有大量CO32-
15. 已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性。现有浓度均为0.1 mol·L-1的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中正确的是
A.c(Na+)=c(HRO3-)+c(RO32-)+c(H 2RO3)
B.c(Na+)+c(H+)=c(HRO3-)+c(RO32-)+c(OH-)
C.c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
D.两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等
14.室温下,某无色透明溶液中由水电离出来的H+和OH-浓度的乘积为1×10-24,则此溶液中可能大量共存的离子组为
A.HCO3-、Al3+、Na+、SO42- B.I-、NO3-、K+、NH4+
C.MnO4-、Cl-、SO42-、K+ D.SiO32-、SO32-、Na+、Cl-
13.NA表示阿伏加德罗常数,下列叙述中不正确的是
A.标准状况下,80g SO3中含3NA个氧原子,体积小于22.4L
B.23 g Na和足量的O2完全反应,无论是常温,还是燃烧,都失去NA个电子
C.含有2NA个阴离子的CaC2,在标准状况下,能产生约44.8L的乙炔气体
D.1molNa218O2与足量的H2O完全反应时转移电子2NA个,生成NaOH80g
12.将一元酸HA的溶液与一元碱BOH的溶液等体积混合,若所得溶液显酸性,下列有关判断正确的是
A.若混合前酸、碱pH之和等于14,则HA肯定是弱酸
B.若混合前酸、碱物质的量浓度相同,则HA肯定是弱酸
C.溶液中水的电离程度:混合溶液>纯水>BOH溶液
D.混合溶液中离子浓度一定满足: c(A-)>c(B+)>c(H+)>c(OH-)
11.对于平衡体系mA(g)+nB(g) pC(g)+qD(g);△H<0。下列结论中正确的是
pC(g)+qD(g);△H<0。下列结论中正确的是
A.若平衡时A、B的转化率之比为m∶n,说明反应开始时,A、B的物质的量相等
B.若温度不变,将容器的体积增大1倍,此时A的浓度变为原来的0.48倍,则m+n>p+q
C.若m+n=p+q,则往含有a mol气体的平衡体系中再加入b mol B,达到新平衡时,气体的总物质的量等于(a+b)
D.若升高温度时,平衡混合气体的平均相对分子质量增大,则m+n>p+q
10.2000年10月10日,诺贝尔化学奖授予美国科学家艾伦·黑格、艾伦·马克迪尔米德和日本科学家白川英树,以表彰他们有关导电聚合物的发现。他们研究发现:经过改造后的塑料能够像金属一样表现导电性能。以聚乙炔为例,要使其能够导电,必须用I2或Na等做掺杂处理,他们用碘做的掺杂实验通式如下:
[CH]n+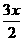 I2→[CH]
I2→[CH] +xI
+xI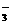 , 则聚乙炔的碳链结构片段和下列叙述正确的是
, 则聚乙炔的碳链结构片段和下列叙述正确的是
①-C≡C-C≡C-C≡C- ②-C=C-C=C-C=C-
③=C=C=C=C=C=C= ④-C=C-C≡C-C=C-C≡C-
⑤这种可导电的聚乙炔塑料是一种纯净物,有固定的熔、沸点
⑥掺杂后的聚乙炔固体常温下之所以能导电,是因为它具有类似盐的结构
⑦聚乙炔和碘的掺杂反应中,聚乙炔被还原
⑧聚乙炔经掺杂反应后,分子内碳链结构未发生变化
A ①⑤ B ②⑧ C ④⑥ D ③⑦
9.下列离子方程式书写正确的是
A.二氧化硫气体通入到过量Ca(ClO)2溶液中:
SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
B.向碳酸氢钾溶液中滴入过量澄清石灰水HCO3-+Ca2++OH-=CaCO3↓+H2O
C.氢氧化铁与足量的氢碘酸溶液反应 Fe(OH)3+3H+=Fe3++3H2O
D.向碳酸氢铵溶液中滴入过量氢氧化钠 HCO3-+OH-=CO32-+H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com