
题目列表(包括答案和解析)
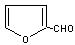
28.
 (10分)已知:HCN的结构为
(10分)已知:HCN的结构为 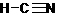 , R-CN
RCOOH,R-Cl+CN-
, R-CN
RCOOH,R-Cl+CN-
 R-CN+Cl-(R为烃基)。玉米芯、甘蔗渣等废物水解发酵后可制得糠醛 ,它是重要的化工原料,它在一定条件下可发生以下变化:
R-CN+Cl-(R为烃基)。玉米芯、甘蔗渣等废物水解发酵后可制得糠醛 ,它是重要的化工原料,它在一定条件下可发生以下变化:
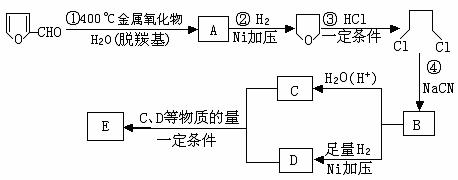
⑴写出反应类型:② ,④ 。
⑵写出反应③的化学方程式: ;
写出能证明糠醛中含有醛基的一个化学反应方程式
。
⑶若E为环状化合物,则其结构简式 。
⑷若E为高聚物,则其结构简式 。
27.(10分)已知下列几种烷烃的燃烧热如下:
|
烷 烃 |
甲烷 |
乙烷 |
丙烷 |
丁烷 |
戊烷 |
|
燃烧热/(kJ·mol-1) |
890.3 |
1559.8 |
2219.9 |
2877.0 |
3536.2 |
今有10L(在标准状况下)某种天然气,假设仅含甲烷和乙烷两种气体,燃烧时共放出热量480kJ。
⑴试写出乙烷气体燃烧的热化学方程式 ;
⑵计算该天然气中甲烷的体积分数
⑶由上表可总结出的近似规律是____________________
_。
(二)乙同学的方案如图所示:
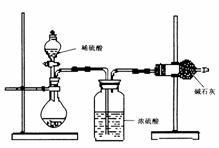 (1)根据乙同学的实验装置图分析,在每次实验中,完成测定过程至少要进行 次称量操作。
(1)根据乙同学的实验装置图分析,在每次实验中,完成测定过程至少要进行 次称量操作。
(2)他重复正确操作了三次,结果数据出现了较大的偏差, 你认为主要原因可能是(任写三个):
① ;
② ;
③ 。
26.(10分)有三份不同质量的铁粉样品①②③,甲、乙、丙三位同学各取一份样品分别与含有0.8molHNO3的稀硝酸反应,反应后硝酸和铁均无剩余,且硝酸的还原产物只有NO。据此回答下列问题:
⑴甲取样品①,反应后溶液中铁只以Fe3+离子形式存在,则样品①的质量为 g。
⑵乙取样品②,反应后溶液中既含有Fe3+、又含有Fe2+离子,则样品②的质量(设为ag)范围是 。
⑶丙取样品③,将其慢慢加入到稀硝酸中,并搅拌,反应过程中溶液里Fe3+、Fe2+、NO3-三种离子中的两种离子的物质的量的变化曲线如下图所示,则该曲线表示的是_____________物质的量变化的曲线,请你在此图中再画出另外2种离子的物质的量的变化曲线。
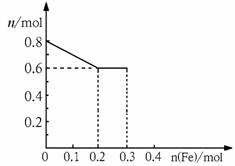
(一)甲同学的方案是:将样品溶解,加过量氧化钡溶液,过滤、洗涤、烘干,称量得固体n g。
(1)混合物中碳酸钠的质量分数为(用m、n表示) 。
(2)甲同学洗涤沉淀的操作是 。
(3)Ca2+、Ba2+ 都可以使 沉淀完全,但使用氯化钡溶液比氯化钙溶液所得的结果具有更高的精确度,原因是:
沉淀完全,但使用氯化钡溶液比氯化钙溶液所得的结果具有更高的精确度,原因是:
① ;
② ;
24.(8分)有A、B、C、D、E、F六种元素,已知:①它们位于三个不同短周期,核电荷数依次增大;②A与E、B与F分别同主族;③B、C都分别能与D按原子个数比1∶1或1∶2形成化合物。
⑴画出F的原子结构示意图____________________,BD2的电子式是____________。
⑵C、D、E的简单离子半径由大到小的顺序是_____________________(填离子符号)。
⑶F能与B、C、D形成化合物(分别用b、c、d表示),它们的晶体都是原子晶体,晶体中F原子之间不直接通过化学键相连,成键后每个原子最外层均为8个电子。当晶体中含有1 mol F原子时,晶体中所含共价键数目的大小关系是
(填化学式)。
25.(12分)为了测定氢氧化钠固体混合物m g中碳酸钠的质量分数,甲、乙两位同学分别设计了如下的实验方案:
23.(8分)电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 。在X极附近
观察到的实验现象是 。
②Y电极上的电极反应式为 。检验该电极反应产物的
方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应为 。
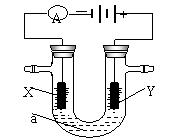 ②Y电极的材料是
,电极反应式
②Y电极的材料是
,电极反应式
为 。
(说明:杂质发生的电极反应不必写出)
22.(10分)为了证明在实验室制备Cl2的过程中会有HCl挥发出来,甲同学设计了如下图
所示的实验装置,按要求回答下列问题。
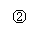 ①
①
 ⑴请根据甲同学的意图,连接相应的装置,接口顺序:b接 , 接 , 接a。
⑴请根据甲同学的意图,连接相应的装置,接口顺序:b接 , 接 , 接a。
⑵实验开始前应先进行的操作是_____________。
⑶装置中Cu的作用______________________________________(用方程式表示)。
 ⑷乙同学认为甲同学实验中有缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出在某两个装置之间再加装置⑤。
⑷乙同学认为甲同学实验中有缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出在某两个装置之间再加装置⑤。
你认为装置⑤应加在 之间(填序号)。瓶中可以放入
。如果实验结论可靠,应观察到的现象
。
⑸丙同学看到乙同学设计的装置后提出无需多加装置,只需将原来烧杯
中的AgNO3溶液换掉。你认为应将溶液换成 ,如果观察到
的现象,则说明甲的实验不可靠。
21.Ⅰ(4分)下列说法中,正确的有
①用试管夹夹持试管时,试管夹从试管底部往上套,夹在试管的中上部
②给盛有液体的体积超过三分之一的试管加热至沸腾
③硝酸、溴水可长期盛放在棕色的滴瓶中
④将试管平放,用纸槽往试管里送入固体粉末后,然后竖立试管
⑤熔融氢氧化钠要在耐高温的石英坩埚中
⑥将烧瓶放在桌上,再用力塞进塞子
Ⅱ(8分)某种胃药片的制酸剂为碳酸钙,某实验小组的同学测其所含碳酸钙的质量,有如下操作:
①需配制0.1 mol·L-1 的盐酸和0.1mol·L-1 的氢氧化钠溶液;
②每次取一粒(药片质量均相同)0.2g的此胃药片,磨碎后加入20.00mL蒸馏水;
③以酚酞为指示剂,用0.1mol·L-1 的氢氧化钠溶液滴定,需用去VmL达滴定终点;
④加入25.00mL0.1mol·L-1 的盐酸溶液。
⑴甲实验过程的步骤为①②④③,乙实验过程的步骤为①②④③②④③,请根据你的实验经历判断 更合理。
⑵下图所示的仪器中配制0.1mol·L-1 盐酸溶液和0.1mol·L-1 氢氧化钠溶液肯定不需要的仪器是(填序号)____,配制上述溶液还需要的玻璃仪器是(填仪器名称) 。

⑶配制上述溶液应选用的容量瓶的规格是(填字母)__________________。
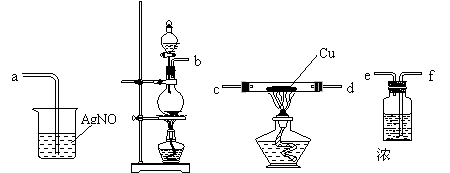 ①50mL、50mL ②100mL、100mL ③100mL、150mL ④250mL、250mL
①50mL、50mL ②100mL、100mL ③100mL、150mL ④250mL、250mL
20.美国 lawrece liremore 国家实验室(LINL)的V·Lota·C·S·You和H·Cynn成功地在高压下将CO2转化为具有类似SiO2结构的晶体,下列关于CO2的原子晶体的说法正确的是
A.CO2的原子晶体和分子晶体互为同分异构体
B.在一定的条件下,转化为分子晶体是物理变化
C.CO2的原子晶体和分子晶体具有相同的物理性质和化学性质
D.在CO2的原子晶体中,每一个C原子周围结合4个O原子,每一个O原子跟两个碳原子结合
第Ⅱ卷(非选择题共80分)
19.在101 kPa时燃烧1 t 含FeS2质量分数为70%的黄铁矿生成固态Fe2O3和气态SO2,放出4.98×106 kJ的热量,表示上述反应的热化学方程式正确的是
A.4FeS2(s)+11O2(g)======2Fe2O3(s)+8SO2(g);△H=+853.7 kJ·mol-1
B.FeS2(s)+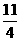 O2(g)======
O2(g)======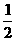 Fe2O3(s)+2SO2(g);△H=-853.7 kJ·mol-1
Fe2O3(s)+2SO2(g);△H=-853.7 kJ·mol-1
C.4FeS2(s)+11O2(g)======2Fe2O3(s)+8SO2(g);△H=+3 414.8 kJ·mol-1
D.FeS2(s)+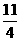 O2(g)======
O2(g)======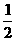 Fe2O3(s)+2SO2(g);△H=-3 414.8 kJ·mol-1
Fe2O3(s)+2SO2(g);△H=-3 414.8 kJ·mol-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com