
题目列表(包括答案和解析)
8.(10分)物质A-K的转化关系如下图所示,已知A是由两种元素组成的化合物;B是非金属单质;J是金属单质。H的相对分子质量比D大16(部分反应物、生成物未列出)。
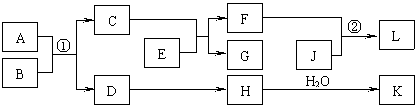
依据上述信息,回答下列问题:
Ⅰ.若A为固体,F是盐,反应①是工业上制取K的重要反应,反应②为化合反应。
⑴ G的电子式是__________。
⑵ 工业上反应①在 (填工业设备名称)中进行。
⑶ 反应①的化学方程式为 。
Ⅱ. 若A为气体,E为活泼金属单质,且K与“Ⅰ”中的K不同。
⑷ 物质A的分子式是____________。
⑸ 反应②的离子方程式为____________________________________________。
7.(10分)盐酸(1分) 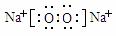 (2分)
(2分)
2Cl―+2H2O Cl2↑+H2↑+2OH-(2分)
Cl2↑+H2↑+2OH-(2分)
2Al+2H2O+2OH-=2AlO2-+3H2↑(2分)
否(1分)
AlCl3、NaAlO2溶液加热蒸干、灼烧,前者获得Al2O3、后者得到的仍是NaAlO2(2分)
7.(10分)(07南通市九校联考)已知下图所示各物质的转化关系中,某些反应部分产物已被省去。其中反应②用于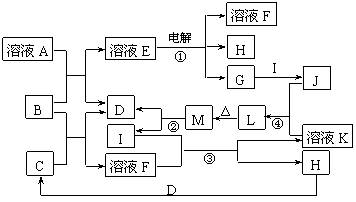 常见金属I的冶炼,B为淡黄色固体, D、G、H均为气体且D、H无色。
常见金属I的冶炼,B为淡黄色固体, D、G、H均为气体且D、H无色。
试回答下列问题:
⑴溶液A为 (写名称),B的电子式 。
⑵反应①的离子方程式 ;
反应③的离子方程式 。
⑶有同学认为M也可由溶液J、溶液K各自加热灼烧获得,试判断这种说法是否正确?
(填“是”或“否”),理由是 。
6.⑴接触室 ⑵HClO + SO2 + H2O = 3H+ + SO42- + Cl-
⑶SO2和H2 ⑷SO3(g)+ H2O(l)=H2SO4(l);△H=-130.3kJ/mol
⑸ (每空2分,共10分)
(每空2分,共10分)
6.(10分)(2006-2007学年第一学期期末调研考试高三化学试题)由短周期元素组成的10种物质A-J间有下图所示的转化关系。已知A、B为同周期相邻元素的单质,其余均为化合物;通常状况下A为固体,B、D为气体,F为液体;A和G的浓溶液加热时反应生成D和F;J在光照时有I生成。试回答:
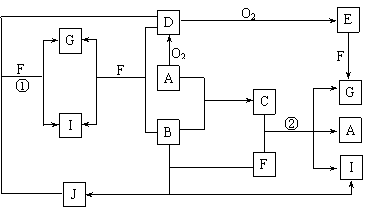
⑴工业生产中实现“D+O2 → E”转化的设备是 。
⑵反应①的离子方程式为 。
⑶足量铁与G的热的浓溶液反应所得气体是 。
⑷在一定条件下,9g液态F吸收49gE气体生成液态G时放出热量65.15kJ,则表示该反应的热化学方程式为 。
⑸C是一种重要的化工产品,为易挥发樱桃红色液体。若反应②中G和A的物质的量之比为1∶2,则C的电子式为 。
5.(8分)⑴NaOH(每空2分,方程式不配平不给分,条件不写扣1分)
⑵①2Al3++6Cl-+6H2O 3H2↑+3Cl2↑+2Al(OH)3↓
3H2↑+3Cl2↑+2Al(OH)3↓
②Al3++3AlO2-+6H2O=4Al(OH)3↓
⑶
5.(8分) (常州市2006-2007学年高三第一学期期末调研). 已知A是由两种中学常见元素组成的化合物,H、D为白色沉淀,E的焰色反应为黄色。A~H各物质之间的关系如图(反应中部分产物已略去,除气体间的反应外,其余反应均在溶液中进行)。
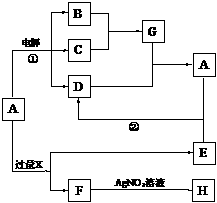 ⑴X的化学式为________________;
⑴X的化学式为________________;
⑵写出反应①、②的离子方程式:
① 。
② 。
⑶用电子式表示G的形成过程:
_________________________________________ 。
4.(8分)(盐城市07二模)江苏省东部沿海有954 km的海岸线,合理开发和利用海洋资源对江苏经济发展意义重大。下图是部分元素的单质及其化合物的转化关系图(有关反应条件及部分反应物
或生成物已略去)。已知:A是海水中的重要资源;C、D、F是单质,其中C、D在常温常压下是气体;反应②是化工生产中的重要反应,生成物E是84消毒液的有效成份;J、K均为不溶于水的物质,其中J为红褐色。

请按要求填空:
(1)反应①的离子方程式(请注明反应条件) 。
(2)B的电子式____;E的化学式____。
(3)③的化学方程式 。
(4)D被誉为很有发展前途的未来燃料。你所了解的实现该目标尚存在的实际问题有
(列举一条)。
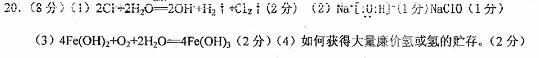
3.(12分)
(1)ab(2分);(2)d(1分);(3)MnO2;KOH(2分);(4)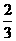 (1分);
(1分);
(5)cd(2分);A(1分);
(6)过滤(1分);溶解度(1分);浓缩结晶(只填“结晶”不给分)(1分)
3.(2007年上海调研卷)
高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。


(1)KMnO4稀溶液是一种常用的消毒剂。其消毒机理与下列物质相同的是______(填代号)。
a. 84消毒液(NaClO溶液) b. 双氧水 c. 苯酚 d. 75%酒精
(2)高锰酸钾保存在棕色试剂瓶,下列试剂保存不需要棕色试剂瓶的是_______(填代号)。
a. 浓硝酸 b. 硝酸银 c. 氯水 d. 烧碱
(3)上述流程中可以循环使用的物质有______________、______________(写化学式)。
(4)若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得__________mol KMnO4。
(5)该生产中需要纯净的CO2气体。若实验室要制备纯净的CO2所需试剂最好选择___________(选填代号)。
a. 石灰石 b. 稀HCl c. 稀H2SO4 d. 纯碱
所需气体发生装置是_____________(选填代号)。
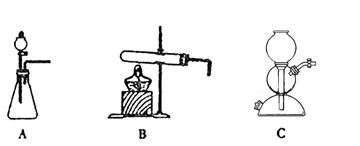
(6)操作Ⅰ的名称是_____________;操作Ⅱ是根据KMnO4和K2CO3两物质在__________(填性质)上差异,采用____________(填操作步骤)、趁热过滤得到KMnO4粗晶体的。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com