
题目列表(包括答案和解析)
3.元素性质呈周期性变化的根本原因是
A.元素原子核外电子排布呈周期性变化
B.元素非金属性、金属性呈周期性变化
C.元素原子半径呈周期性变化
D.元素化合价呈周期性变化
2.在消毒剂家族中,臭氧(O3)和过氧乙酸的贡献并驾齐驱。臭氧(O3)利用其强氧化性可以杀灭病菌,反应后放出无污染的O2。下列关于O3的说法正确的是
A.O3与O2互为同分异构体 B.O3与O2互为同素异形体
C.O3与O2是同系物 D.O3与O2的化学性质相同
1.下列有关化学用语正确的是
A.氮原子的原子结构示意图:1s22s22p3 B.铵根离子的电子式:NH4+
C.烧碱的化学式:NaOH D.甲酸的结构简式:CH2O2
18. (1)S 2S2-+SO32-+6H+===3S↓+3H2O
(2)Al(OH)3 Al3++3HCO3-===Al(OH)3↓+3CO2↑
(3)BaCO3,可能有BaSO4 在沉淀丙中加入足量盐酸,若沉淀不能全部溶解,说明除BaCO3外,还有BaSO4,若全部溶解,则仅有BaCO3
(4)五种可能;①CO2;②H2S;③SO2;④CO2、H2S;⑤CO2、SO2
(5)S2-、SO32-、AlO2-、Na+
17.(1)NaNO3
(2)3Fe+2NO3-+8H+?3Fe2++2NO↑+4H2O(或Fe+NO3-+4H+?Fe3++NO↑+2H2O,2Fe3++Fe=3Fe2+)
(3)由反应④:NO+2HNO3(浓)=3NO2+H2O可知浓HNO3中不可能生成NO
(4)4Fe(NO3)2+4Na2O+6H2O=4Fe(OH)3↓+O2↑+8NaNO2
16.(1)(NH4)2SO3或NH4HSO3;(NH4)2SO4;SO2;NH3;K2SO3;K2SO4
(2)K2SO3+Br2+H2O?K2SO4+2HBr
(3)F中的阴离子是硫酸根离子,可以加盐酸、BaCl2溶液来鉴别。
15.(1) +[:H]?;离子晶体 (2)NH4++H- +H2O?NH3·H2O+H2↑;快的多
(3)NH4H?NH3↑+H2↑
14. (1)A:二氧化硅 B:氧化钙 Z:乙炔:
(1)A:二氧化硅 B:氧化钙 Z:乙炔:
18. 某无色溶液,其中有可能存在的离子如下:Na+、Ag+、Ba2+、Al3+、AlO2-、S2-、CO32-、SO32-、SO42-。现取该溶液进行有关实验,实验结果如下所示:
某无色溶液,其中有可能存在的离子如下:Na+、Ag+、Ba2+、Al3+、AlO2-、S2-、CO32-、SO32-、SO42-。现取该溶液进行有关实验,实验结果如下所示:
(1)沉淀甲是_______,生成沉淀甲的离子方程式为_____________。
(2)沉淀乙是_______,由溶液甲生成沉淀乙的离子方程式为___________。
(3)沉淀丙是_______,用化学实验来确定其成分,其方法是___________。
(4)气体甲的成分有哪几种可能?答:______________________________。
(5)综合上述信息,可以肯定存在的离子__________________________。
08届高三化学期末训练题
元素化合物答案 (08.1.18)
选择题DBCAB BDBDB AD B
13(1)S 接触室
(2)NO2 ①动力、设备、材料等条件 ②反应速率、H2的转化率和催化剂的活性等
(3)CH3CH2OH或CH4 NaCl(依据A发生分解反应确定的其他符合题意的答案也可)
17.物质A-H有如下图所示转化关系(部分反应物、生成物没有列出)。其中,B的浓溶液与单质X在加热时才能发生反应①,B的稀溶液与足量X发生反应②,向C溶液中滴入KSCN溶液呈红色。试填写下列空白:
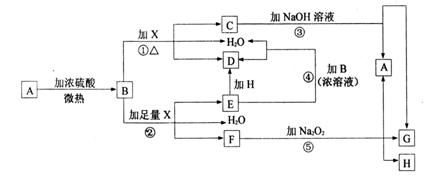
(1)晶体A是(化学式) ;
(2)反应②的离子方程式: ;
(3)根据图示信息判断,足量B的浓溶液与单质X共热时能否产生E,说明理由(用化学方程式回答): ;
(4)在反应⑤中,若生成物G与H的物质的量之比为4∶1,写出F溶液与Na2O2反应的化学方程式: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com