
题目列表(包括答案和解析)
2.中学化学教材中有大量数据,下列为某同学对数据的利用情况,其中不正确的是
A 用NaOH和HCl 反应测得的中和热,推算一定量稀H2SO4和NaOH 溶液反应的反应热
B 用沸点数据推测两种液体混合物用蒸馏方法分离开来的可能性
C 用沸点数据来分析分子的稳定性
D 用原子(或离子)半径数据推断某些原子(或离子)氧化性或还原性强弱
1.不具有放射性的同位素称之为稳定同位素,近20年来,稳定同位素分析法在植物生理学、生态学和环境科学研究中获得广泛应用。如在陆地生态系统研究中,2H、13C、15N、18O、34S等常用做环境分析指示物。下列说法中正确的是
A.34S原子核内的中子数为16
B.1H216O在相同条件下比1H218O更易蒸发
C.13C和15N原子核内的质子数相差2
D.2H+的酸性比1H+的酸性更强
31.已知3NO2+H2O→2HNO3+NO,NO+NO2+2NaOH→2NaNO2+H2O。
(1)将0.15 mol NO2气体缓慢地通入49.6 mL的水(密度为1.0 g/cm3)中,NO2与水充分反应,所得到的溶液中硝酸的物质的量为 。
(2)若上述所得溶液的密度为1.1 g/cm3,求所得硝酸溶液的物质的量浓度。
(3)如上述NO2气体通入水中速度过快,部分NO2尚未与水反应便逸出,所得到的尾气中NO和NO2的体积比为2:3,将些混和气体缓缓通入足量NaOH溶液充分反应后,气体全部被吸收,求所得溶液中NaNO3和NaNO2的物质的量之比。
30.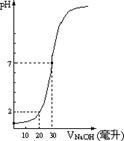 下图为10mL一定物质的量浓度的盐酸X,用一定物质量浓度的NaOH溶液Y滴定的图示,试计算:
下图为10mL一定物质的量浓度的盐酸X,用一定物质量浓度的NaOH溶液Y滴定的图示,试计算:
(1) 盐酸X和NaOH溶液Y的物质的量浓度之比为多少?
 (2) 盐酸X的物质的量浓度为多少?
(2) 盐酸X的物质的量浓度为多少?
29.以石油裂解得到的乙烯和1,3-丁二烯为原料,经过下列反应合成高分子化合物H,该物质可用于制造以玻璃纤维为填料的增强塑料(俗称玻璃钢)。
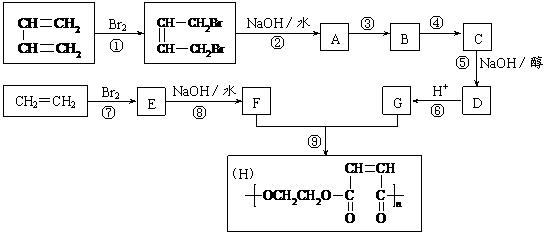
请按要求填空:
(1)写出上述指定反应的化学反应类型:
反应① ,反应⑤ ,反应⑧ 。
(2)反应②的化学方程式是 。
(3)反应③、④中有一反应是与HCl加成,该反应是 (填反应编号),设计这一步反应的目的是 ,物质C的结构简式是 。
(4)写出A的同分异构体(要求不含甲基并能发生银镜反应) 。

28.蒽(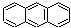 )与苯炔(
)与苯炔( )反应生成化合物X(X结构中三个苯环呈立体对称结构),如下图:
)反应生成化合物X(X结构中三个苯环呈立体对称结构),如下图:

(1)蒽与X都属于 (填编号)。
a.环烃 b.不饱和烃 c.烷烃 d.芳香烃
(2)苯炔的分子式为 ,苯炔不具有的性质 (填编号)。
a.能溶于水 b.能发生氧化反应 c.能发生加成反应 d.常温常压下为气体
(3)X的一个氢原子被甲基取代的所有同分异构体数为 (填编号)。
a.2种 b.3种 c.4种 d.5种
27.已知室温下乙醛的沸点为20.8℃,且与水互溶。用HgSO4做催化剂,在75℃左右,乙炔可水化为乙醛,但HgSO4遇到某些特定物质常会发生催化剂中毒而失去催化作用,H2S就是其中一种:现用乙炔水化法,只用块状电石、浓硫酸、水、NaOH溶液、HgO粉末五种物质制取乙醛,装置如下图所示,请回答下列问题;
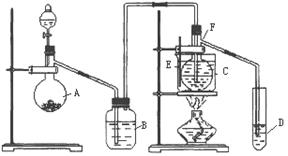
(1)实验开始时,仪器A中盛放电石,B中应装 ,其作用是
。
(2)仪器D中盛放水,其作用是 。
(3)蒸馏烧瓶F中应加入HgO和另外两种试剂,若将三者分别直接加入,请按加入的先后顺序写出包括HgO在内的各试剂的名称 。将HgO加放到F中的操作方法是 。
(4)装置图中,加热F的方法叫 ,所选用温度计F的量程表示正确的是
(填代号)。
A.0℃-50℃ B.0℃-100℃ C.0℃-200℃ D. 0℃-360℃
(5)检验乙醛已制出的操作及现象是
。

26.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
|
实验编号 |
HA物质的量浓度(mol/L) |
NaOH物质的量浓度(mol/L) |
混合溶液的pH |
|
甲 |
0.2 |
0.2 |
pH=a |
|
乙 |
c1 |
0.2 |
pH=7 |
|
丙 |
0.2 |
0.1 |
pH>7 |
|
丁 |
0.1 |
0.1 |
pH=9 |
请回答:
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸 。
(2)不考虑其它组的实验结果,单从乙组情况分析,c1 (填“一定”或“不一定”)等于0.2mol/L,混合溶液中离子浓度c(A-)与c(Na+)的大小关系是 。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HA是 酸(填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是 。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)= mol/L,写出该混合溶液中下列算式的精确结果(不能做近似计算): c(Na+)-c(A-)= mol/L。
25.已知N2O4 和NO2在一定条件下存在如下平衡: -Q(Q>0)。100℃时,将0.200mol的四氧化二氮气体充入2L的密闭容器中,在不同时间对该容器内的物质进行测定,得到如下数据:
-Q(Q>0)。100℃时,将0.200mol的四氧化二氮气体充入2L的密闭容器中,在不同时间对该容器内的物质进行测定,得到如下数据:
|
时间(s) 浓度(mol/L) |
0 |
20 |
40 |
60 |
80 |
100 |
|
c(N2O4) |
0.100 |
c1 |
0.050 |
c3 |
a |
b |
|
c(NO2) |
0.000 |
0.060 |
c2 |
0.120 |
0.120 |
0.120 |
试填空:
(1)该反应的平衡常数表达式为K= ,
 表中c1= ,c2=
;a b(填“=”,“>”或“<”)。
表中c1= ,c2=
;a b(填“=”,“>”或“<”)。
(2)在0-20s内,四氧化二氮的平均反应速率
为 。
(3)请在右边的坐标图中画出四氧化二氮的
浓度随时间变化的曲线图。
(4)若要测定NO2气体的相对分子质量,
在下列条件下测定时可以减小误差的是 。
A.升高温度 B.降低温度
C.增大压强 D.减小压强
24.一定温度下,当弱酸在溶液中达到电离平衡时,各微粒的浓度存在一种定量的关系。若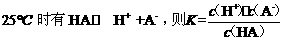 。式中:K为电离平衡常数,只与温度有关,c为各微粒在达到平衡时的浓度。下表是几种常见弱酸的电离平衡常数(25℃)。
。式中:K为电离平衡常数,只与温度有关,c为各微粒在达到平衡时的浓度。下表是几种常见弱酸的电离平衡常数(25℃)。
|
酸 |
电离方程式 |
电离平衡常数K |
|
CH3COOH |
CH3COOH CH3COO-+H+ CH3COO-+H+ |
1.76×10-5 |
|
H2CO3 |
H2CO3 H++HCO3- H++HCO3-HCO3-  H++CO32- H++CO32- |
K1==4.31×10-7 K2==5.61×10-11 |
|
H2S |
H2S H++HS- H++HS-HS-  H++S2- H++S2- |
K1==9.1×10-8 K2==1.1×10-12 |
回答下列各题:
(1)K只与温度有关,温度升高时, (填“促进”或“抑制”)弱酸的电离,K值 (填“增大”、“减小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱关系是 。
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-都看作是酸,其中酸性最强的是 ,最弱的是 。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2之间存在一定关系,此关系是 ,由此关系可看出多元弱酸的酸性主要由第 步电离决定。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com