
题目列表(包括答案和解析)
23.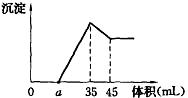 (7分)准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2),放入100mL浓度的H2SO4溶液中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀与加入NaOH溶液的体积的关系如右图所示,
(7分)准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2),放入100mL浓度的H2SO4溶液中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀与加入NaOH溶液的体积的关系如右图所示,
求:(1)H2SO4溶液的物质的量浓度;
22.(5分)将2molN2和8mol H2在适宜条件下按下式进行反应:N2+3H2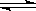 2NH3,当在某一温度下达到化学平衡状态,若测得平衡混合气体对氢气的相对密度为4.19时,求N2的转化率?
2NH3,当在某一温度下达到化学平衡状态,若测得平衡混合气体对氢气的相对密度为4.19时,求N2的转化率?
21.(10分)某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验室按以下步骤进行:
① 称量a g样品,置于烧杯中;
② 加入适量盐酸和适量蒸馏水,使样品溶解,然后准确配制成250mL溶液;
③ 准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,加热使反应完全;
④ 趁热迅速加入过量氨水,充分搅拌,使沉淀完全;
⑤ 过滤,洗涤沉淀;
⑥ 将沉淀转移到坩埚内,加热、搅拌,直到固体全部由红褐色变为红棕色后,在干燥器中冷却至室温后,称量;
⑦ 重复以上操作,至最后两次称得的质量不超过0.1g为止。
请根据上面叙述,回答:
 (1)下图所示仪器中,本实验步骤①②③中必须用到的仪器是E和 (填字母)。
(1)下图所示仪器中,本实验步骤①②③中必须用到的仪器是E和 (填字母)。
A B C D E F G
(2)写出步骤③中发生反应的离子方程式 。
(3)洗涤是洗去附着在沉淀上的 (写离子符号),洗涤沉淀的操作是 。
(4)若坩埚质量是W1,坩埚于加热后固体总质量是W2,则样品中铁元素的质量分数为 。
(5)该兴趣小组中甲学生认为:实验步骤③中不加入氯水,其余步骤不变,仍可达到目的。你认为甲学生的观点是否正确 (填正确或错误),请说明理由: 。
20.(8分)
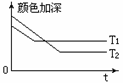 (1)反应A+B
(1)反应A+B 2C,其中A为有色气态物质,其混合物颜色深浅与反应时间,
2C,其中A为有色气态物质,其混合物颜色深浅与反应时间,
温度(T)之间的关系如图所示(B、C均为无色物质):
①该反应是_______热反应;
②若A、B、C均为气态物质,增大压强,B的转化率________,混合气体的颜色 。
(2)化学平衡移动原理,同样也适用于其他平衡,已知在氨水中存在下列平衡:
NH3+H2O NH3·H2O
NH3·H2O NH4++OH-
NH4++OH-
①向氨水中加入MgCl2固体时,平衡向 移动,OH-的浓度_______,NH4+的浓度 。
②向浓氨水中加入少量NaOH固体,平衡向 移动,此时发生的现象 。
19.(8分)下图是常见无机物A-M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,B和C都是极易溶于水的气体,C与AgNO3溶液反应生成不溶于稀硝酸的白色沉淀,E是一种红棕色气体,I是红褐色沉淀,K是由第三周期元素组成的单质中熔点最高的金属。
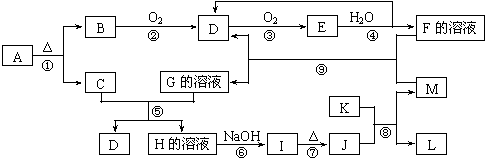
请填写下列空白:
(1)B分子的电子式为____________________________
(2)在反应②中氧化剂与还原剂的物质的量之比为___________________。
(3)写出反应⑧的化学方程式 。
(4)反应⑤的离子方程式是:__________________________________________。
18.(8分)
(1)将等体积等物质的量浓度的盐酸和氨水混合后,呈_____性,溶液中c(NH4+)与c(Cl-)的大小关系是___________________;
(2)将PH=3的盐酸和PH=11的氨水等体积混合后溶液呈____性,溶液中c(NH4+)与c(Cl-)的大小关系是___________________;
(3)将物质的量浓度相同的盐酸与氨水混合后,溶液中c(NH4+)与c(Cl-)浓度相等,则混合溶液呈_____性,与体积大小关系是_________________;
(4)将m mol· L-1的盐酸和n mol·L-1氨水等体积混合后,溶液的PH=7,m与n的大小关系是
,则盐酸中c(H+)与氨水中c(OH-)的大小关系是_______。
17.(6分)下表由元素周期表的前三周期去掉副族上方的空白区域后组合而成,表中虚线处为ⅡA、ⅢA族的连接处。请用相应的化学用语回答下列问题:
|
a |
|
|
|
|
|
|
|
|
b |
 |
 |
c |
d |
e |
f |
|
|
g |
|
h |
|
|
|
|
|
(1)写出仅由e形成的两种带有相同电荷数的阴离子的符号: 、 。
(2)h的单质能与g元素的最高价氧化物对应的水化物的溶液反应,请写出该反应的离子方程式 。

(3)上左图是表示第三周期8种元素单质的熔点(℃)柱形图,已知柱形“1”代表Ar,则其中柱形“8”代表 。(填化学式)
(4)b、c、d、e、f的氢化物的沸点(℃)直角坐标图(上右图),序列“5”的氢化物的名称是 ,序列“2”的氢化物的结构式为 。
16.把ag铁铝合金粉末溶于足量盐酸中,加入过量NaOH溶液。过滤出沉淀,经洗涤、干燥、灼烧,得到红棕色粉末的质量仍为ag,则原合金中铁的质量分数为
A.30% B.47.6% C.52.4% D.70%
15.一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。若用0.1000 mol·L-1的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol·L-1)为
提示:①H2C2O4是二元弱酸;
②10[KHC2O4·H2C2O4]+8KMnO4+17H2SO4=8MnSO4+9K2SO4+40CO2↑+32H2O
A.0.08000 B.0.008889 C.0.1200 D.0.2400
14.假设体积可以相加,下列叙述正确的是
A.0.2 mol·L-1的盐酸,与等体积水混合后pH=1
B.pH=3的醋酸溶液,稀释至10倍后pH=4
C.95 ℃纯水的pH<7,说明加热可导致水呈酸性
D.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com