
题目列表(包括答案和解析)
8.用足量的CO还原32.0 g某种氧化物,将生成的气体通入足量澄清石灰水中,得到60 g沉淀,则该氧化物是
A.FeO B.Fe2O3 C.CuO D.Cu2O
7. 石灰在工农业生产和建筑业上有着重要用途。用于生产石灰的主要原料是石灰石(用①表示),在石灰窑中加热焙烧石灰石得到生石灰(用②表示),并放出气体(用③表示)。生石灰在建筑业上主要用作粘合剂,一般先使它“熟化”变成熟石灰(用④表示),熟石灰与砂子混合成灰泥用于砌筑砖墙。经过一段时间后灰泥中的熟石灰变成另-固体物质(用⑤表示)。用下列化学式表示着5种物质都正确的是
A.①Ca(OH)2,②CaO,③SO3,④CaSO4,⑤CaSO4
B.①CaO,②Ca(OH)2,③CO,④CaCO3,⑤CaSiO3
C.①CaCO3,②CaO,③CO2,④Ca(OH)2,⑤CaCO3
D.①CaCO3,②CaO,③SO2,④CaSiO3,⑤Ca(OH)2
6.把少量CO2分别通入到浓度相同的①Ba(NO3)2溶液;②Ba(OH)2溶液;③溶有氨的BaCl2溶液中。预计能观察到白色沉淀的溶液是
A .②和③ B.只有① C.①和② D.只有③
5.为制备干燥、纯净的CO2,将大理石和盐酸反应生成的气体先后通过装有下列物质的两个吸收装置,两个装置中应依次装入
A. 无水CaCl2固体; 水 B.饱和NaHCO3溶液;浓H2SO4
C.浓H2SO4;饱和Na2CO3溶液 D.饱和Na2CO3溶液;稀H2SO4
4.当下列物质:①大理石 ②钟乳石 ③锅垢 ④贝壳 ⑤蛋壳,分别滴加醋酸时,会产生相同气体的
A.只有①② B.只有③④ C.只有①②③ D.是①②③④⑤
3.(2007年高考理综上海卷,环保)目前,关于二氧化碳是否为大气污染有不同的观点。认为“二氧化碳不是大气污染物”的理由是
①二氧化碳是重要的化工原料;②二氧化碳是植物光合作用的必需原料;③二氧化碳是无色、无味、无毒的气体;④除二氧化碳外,甲烷、一氧化二氮也是温室气体
(A)①② (B)②③ (C)③④ (D)①④
2. 为了控制温室效应。各国科学家提出了不少方法和设想。有人根据液态CO2密度大于海水密度的事实,设想将CO2液化后,送入深海海底。以减小大气中CO2的浓度。为使CO2液化,可采用的措施是
A 减压、升温 B 增压、升温 C 减压、降温 D 增压、降温
1.(2007年高考海南化学卷,硅)下列物质中,不含有硅酸盐的是
(A)水玻璃 (B)硅芯片 (C)黏土 (D)普通水泥
28(A).2005年诺贝尔化学奖授予三位在绿色化学领域有突出成就的科学家,绿色化学核心是实现零排放,而加成反应和化合反应实现了零排放。重氮甲烷在有机合成中有重要应用,可以用来合成甲醚、羧酸、酯类等重要有机产物。重氮甲烷的分子结构可以表示为 CH2-N≡N,在其分子中,碳原子和氮原子之间的共用电子对是由氮原子一方提供的。
(1)重氮甲烷的电子式为 。
(2)重氮甲烷在受热或光照时容易分解放出氮气,同时生成一个极活泼的缺电子基团亚甲基或称为碳烯(:CH2)。碳烯是一个反应中间产物,只能在反应中短暂存在,大约只能存在一秒钟。碳烯的电子式是 。
(3)碳烯很容易与烯烃、炔烃发生加成反应,生成三元环状化合物。碳烯与丙烯发生加成反应后所得产物的结构简式为 。
(4)碳烯还可以插入到C-H键,C-C键之间,使碳链加长,当它插入丙烷分子中C-H键之间,碳链增长后的化合物的结构简式为 或 。
(5)请分别写出碳烯与2-丁烯、苯反应的化学方程式(有机物用结构简式表示):
① ;
②
28(B).(10分)A、B、C、D、E都是短周期元素,原子序数依次增大,B、C同周期,C的非金属性最强,A、D同主族隔周期,E元素原子最外层的p亚层电子数是s亚层电子数的一半。A、B能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1。根据以上信息回答下列问题:
⑴甲、乙两分子中含有非极性共价键的物质的电子式是________________ ,
C元素在周期表中的位置是__________________。
⑵C和D的离子中,半径较小的是__________(填离子符号)。
⑶将D的单质投入甲中,待D消失后再向上述溶液中加入E的单质,此时发生反应的化学方程式是_____________ ________ __
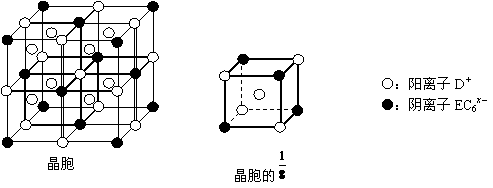
⑷C、D、E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子D+(用○表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用●表示)位于该正方体的顶点和面心。该化合物的化学式是_________ 。
(5)如图,铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化。下列说法正确的是
A.γ-Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
B.α-Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
C. 若δ-Fe晶胞边长为acm,α-Fe晶胞边长为bcm,则两种晶体密度比为2b3:a3
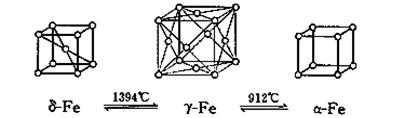 D.将铁加热到1500℃分别急速冷却和缓慢冷却,得到的晶体类型相同
D.将铁加热到1500℃分别急速冷却和缓慢冷却,得到的晶体类型相同
27.(10分)聚合氯化铝晶体的化学式为[Al2(OH)nCl6-n·xH2O]m,它是一种高效无机水处理剂,它的制备原理是调节增大AlCl3溶液的pH,通过促进其水解而结晶析出。其制备原料主要是铝加工行业的废渣--铝灰,它主要含Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产的工艺流程如下:

(1)搅拌加热操作过程中发生反应的离子方程式 ;
。
(2)生产过程中操作B和D的名称均为 (B和D为简单操作)。
(3)反应中副产品a是 (用化学式表示)。
(4)生产过程中可循环使用的物质是 (用化学式表示)。
(5)调节pH至4.0~4.5的目的是
(6)实验室要测定水处理剂产品中n和x的值。为使测定结果更准确,需得到的晶体较纯净。生产过程中C物质可选用 。
A.NaOH B.Al C.氨水 D.Al2O3 E.NaAlO2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com