
题目列表(包括答案和解析)
25. (10分)水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-,各形态的浓度分数α随溶液pH变化的关系如图所示:
(10分)水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-,各形态的浓度分数α随溶液pH变化的关系如图所示:
[1表示Pb2+,2表示Pb(OH)+,3表示Pb(OH)2,4表示Pb(OH)3-,5表示Pb(OH)42-]
⑴Pb(NO3)2溶液中,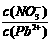 2(填“>”、“=”、“<”);往该溶液中滴入氯化铵溶液后,
2(填“>”、“=”、“<”);往该溶液中滴入氯化铵溶液后,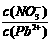 增加,可能的原因是
。
增加,可能的原因是
。
⑵往Pb(NO3)2溶液中滴稀NaOH溶液,pH=8时溶液中存在的阳离子(Na+除外)有
,pH=9时,主要反应的离子方程式为 。
⑶某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:

 离子
Pb2+ Ca2+ Fe3+ Mn2+ Cl-
离子
Pb2+ Ca2+ Fe3+ Mn2+ Cl-
处理前浓度/(mg·L-1) 0.100 29.8 0.120 0.087 51.9
处理后浓度/(mg·L-1) 0.004 22.6 0.040 0.053 49.8

上表中除Pb2+外,该脱铅剂对其它离子的去除效果最好的是 。
⑷如果该脱铅剂(用EH表示)脱铅过程中主要发生的反应为:
2EH(s)+Pb2+ E2Pb(s)+2H+
E2Pb(s)+2H+
则脱铅的最合适pH范围为 (填代号)。
A.4-5 B.6-7 C.9-10 D.11-12
24. (10分)三农问题是政府和社会关注的问题,化肥是土地的营养品。某农资商店出售一种化肥,其有效成分为氯化铵,现欲测定该种化肥中氮元素的质量分数,设计实验步骤如下(杂质中不含氮元素,且杂质均不与盐酸或氢氧化钠溶液反应):
①配制1.00 mol/L的HCl溶液和1.00 mol/L的NaOH溶液;
②每次取1.00 g此化肥样品,溶于20 mL蒸馏水中;
③加入30.00 mL1.00 mol/L的NaOH溶液,将反应后的溶液加热煮沸约1分钟,冷却至常温;
④以酚酞为指示剂,用1.00 mol/L的HCl溶液滴定,达到滴定终点用去V(mL);
⑤重复②③④步操作1-2次;
⑥记录整理实验所得数据,计算该化肥中氮元素的质量分数。
请回答下列问题:
(1)写出实验步骤④中的离子方程式: 。
(2)下列仪器中,配制盐酸和氢氧化钠溶液都能用到的是( )
A.玻璃棒 B.托盘天平 C.烧杯 D.漏斗
(3)步骤⑤的实验目的是 。
(4)配制本实验所需的1.00 mol/L的盐酸和1.00 mol/L的NaOH溶液从节约化学药品的角度出发,最好应选用的容量瓶规格分别为 (填字母选项)。
A.50mL,50mL B. 100mL,100mL C. 100mL,150mL D. 250mL,500mL
(5)若以Vx(mL)表示实验所测定消耗盐酸数据的平均值,该化肥样品中氮元素的质量
分数计算表达式为 。(不需要化简)
23. (13分)实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
4NH4+ +6HCHO =3H++6H2O+(CH2)6N4H+ [滴定时,1 mol (CH2)6N4H+与 l mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤I 称取样品1.500 g。
步骤II 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤III 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤III 填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积__________(填“偏大”、“偏小”或“无影响”)
③滴定时边滴边摇动锥形瓶,眼睛应观察____________
(A)滴定管内液面的变化 (B)锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由_________色变成_________色。
(2)滴定结果如下表所示:
|
滴定 次数 |
待测溶液的体积 /mL |
标准溶液的体积/mL |
|
|
滴定前刻度 |
滴定后刻度 |
||
|
1 |
25.00 |
1.02 |
21.03 |
|
2 |
25.00 |
2.00 |
21.99 |
|
3 |
25.00 |
0.20 |
20.20 |
若NaOH标准溶液的浓度为0.1010 mol·L-1,则该样品中氮的质量分数为___________。
22. 经测定某种溶液中只含NH4+、Cl-、H+、OH-四种离子,下列说法错误的是 ( )
A.溶液中四种粒子之间可能满足:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
B.若溶液离子间满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+),则溶液中溶质一定是NH4Cl和NH3·H2O
C.若溶液离子间满足:c(Cl-)>c(NH4+)>c(OH-)>c(H+),则溶液中溶质只有NH4Cl
D.若溶液离子间满足:c(NH4+)=c(Cl-)则溶液中一定呈中性
第Ⅱ卷( 非选择题 共84分 )
21.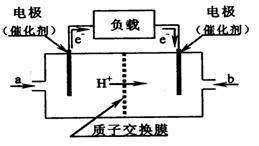 如图是某公司批量生产的笔记本电脑所用的甲醇燃料电池的构造示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,该电池总反应式为:2CH3OH+3O2=2CO2+4H2O。
如图是某公司批量生产的笔记本电脑所用的甲醇燃料电池的构造示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,该电池总反应式为:2CH3OH+3O2=2CO2+4H2O。
下列有关该电池的说法错误的是( )
A. 右边的电极为电池的负极,b处通入的是空气
B. 左边的电极为电池的负极,a处通入的是甲醇
C. 电池负极的反应式为:2CH3OH+2H2O-12e-=2CO2+12H+
D. 电池正极的反应式为:3O2+12H++12e-=6H2O
20. 氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是
( )
A. 再通入少量氯气,c(H+)/c(ClO-)减小
B. 通入少量SO2,溶液漂白性增强
C. 加入少量固体NaOH,一定有c(Na+)=c(Cl-)+c(ClO-)
D. 加入少量水,水的电离平衡向正反应方向移动
19. 下列各组离子在溶液中能大量共存,当加入过量氨水后也不产生沉淀的是 ( )
A. Na+、Fe3+、Cl-、I- B. K+、AlO2-、NO3-、OH-
C. H+、NH4+、Al3+、SO42- D. H+、Cl-、CH3COO-、NO3-
18. 下列离子反应方程式不正确的是 ( )
A. KHCO3的水解:HCO3-+H2O
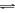 H3O++CO32-
H3O++CO32-
B. NaHSO4溶液与Ba(OH)2溶液混合呈中性:
2HSO4-+Ba2++2OH-=BaSO4↓+SO42-+2H2O
C. 将过量铁粉加入到稀硝酸中:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
D. 碳酸氢钙溶液中加入足量石灰水:Ca2++HCO3-+OH-= CaCO3↓+H2O
17. 已知NaH2PO4、NaHC2O4、NaHSO3的水溶液的pH均小于7,由此可以推断 ( )
A. H3PO4、H2C2O4、H2SO3都是弱酸
B. H2PO4-、HC2O4-、HSO3-、的电离程度小于其水解程度
C. H3PO4、H2C2O4、H2SO3、的酸性均强于H2CO3
D. NaH2PO4、NaHC2O4、NaHSO3只能与强碱反应,不能与强酸反应
16. MOH和ROH两种碱的溶液分别加水稀释时,pH变化如右图所示。下列叙述中正确的是 ( )
A. MOH是一种强碱
B. 在x点,MOH完全电离
C. 在x点,c(M+)==c(R+)
D. 稀释前,c(ROH)==10c(MOH)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com