
题目列表(包括答案和解析)
5、若某电能与化学能的转化装置(电解池或原电池)中发生反应的总反应离子方程式是: Cu+2H+=Cu2++H2↑,则关于该装置的有关说法正确的是 ( )
A.该装置可能是原电池,也可能是电解池
B.该装置只能是原电池,且电解质溶液为硝酸
C.该装置只能是电解池,电解质溶液不可能是盐酸
D.该装置只能是电解池,且金属铜为该电解池的阳极
|
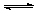 2CO32-+ 6H2O,则下列说法正确的是 ( )
2CO32-+ 6H2O,则下列说法正确的是 ( )
A.放电时CH3OH参与反应的电极为正极
B.放电时负极的电极反应为:CH3OH
- 6e- + 8OH- CO32-+6H2O
CO32-+6H2O
C.标准状况下,通入5.6LO2,并完全反应后,有0.5mol电子转移
D.放电一段时间后,通入O2的电极附近溶液的pH降低
4、用电解水的方法分析水的组成时,需要加入一些电解质以增强水的导电性,不宜加入的物质是 ( )
A.Na2SO4 B.NaNO3 C.KOH D.CuSO4
3、下列是爱迪生电池分别在充电和放电时发生的反应:Fe + NiO2+2H2O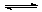 Fe(OH)2+ Ni(OH)2下列对爱迪生蓄电池推断错误的是
( )
Fe(OH)2+ Ni(OH)2下列对爱迪生蓄电池推断错误的是
( )
① 放电时,Fe参与负极反应,NiO2参与正极反应
② 充电时,阴极上的电极反应式为:Fe(OH)2 + 2e- = Fe + 2OH-
③ 放电时,电解质溶液中的阴离子向正极方向移动
④ 放电时,负极上的电极反应式为:Fe + 2H2O-2e- = Fe(OH)2 + 2H+
 ⑤ 蓄电池的电极必须浸入某种碱性电解质溶液中
⑤ 蓄电池的电极必须浸入某种碱性电解质溶液中
A.只有③ B.③④ C.④⑤ D.①②⑤
2、我国镍氢电池居世界先进水平,我军潜艇将装备国产大功率镍氢动力电池,常见镍氢电池的某极是储氢合金LaNi5H6(LaNi5H6中各元素化合价均为零),电池反应通常表示为LaNi5H6+6NiO(OH) LaNi5+6Ni(OH)下列说法正确的是
( )
LaNi5+6Ni(OH)下列说法正确的是
( )
A. 放电时储氢合金作正极
B.放电时负极反应:LaNi5H6+6OH--6e- = LaNi5+6H2O
C.充电时阳极周围c(OH-)增大
D.充电时储氢合金作负极
1、已知蓄电池在充电时作电解池,放电时作原电池。铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“-”。关于标有“+”的接线柱,下列说法中正确的是 ( )
A.充电时作阳极,放电时作正极 B.充电时作阳极,放电时作负极
C.充电时作阴极,放电时作负极 D.充电时作阴极,放电时作正极
30. 某同学利用废铁屑制备FeCl3·6H2O,该同学设计了如右图所示的实验装置。
 实验时,关闭c,打开b和a;从分液漏斗内向A中加过量的稀盐酸;
实验时,关闭c,打开b和a;从分液漏斗内向A中加过量的稀盐酸;
充分反应后,打开c进行过滤;取烧杯内溶液倒入蒸发皿加热,蒸
发掉部分水并使多余HNO3分解,再降温结晶得FeCl3·6H2O晶体。
请回答下列问题:
(1)检查装置A的气密性的方法是:
。
(2)不采用直接将烧杯内溶液蒸发至干的方法,来制得FeCl3·6H2O
晶体的理由是
。
(3)由于烧杯中装的是稀HNO3,所以用该法制取FeCl3•6H2O晶
体有不足之处,这个不足之是 ,
改进的方法是,
。
(4)测定从B处导出气体的体积V,可以计算出废铁屑的纯度。此
时在导管口B处还需连接一个装置,该装置所需要用到玻璃仪器有
(填仪器名称) 。
(5)若加入的废铁屑为mg,测出所产生气体的体积为V L (已折算成标准状况),则废铁屑
的纯度用m、V的代数式可表示为: 。
29. (12分)为了测定血液中钙离子的含量,取5毫升血液样品,稀释成50毫升,从中取出10毫升,加入过量草酸钾(K2C2O4)溶液,使钙离子完全转化成草酸钙沉淀。滤出并洗净所得草酸钙沉淀,用过量稀硫酸溶解,生成草酸和硫酸钙稀溶液。往溶液中加入10毫升0.0020 mol/L的KMnO4溶液,使草酸完全被氧化,再用FeSO4溶液滴定过量的KMnO4溶液,当KMnO4溶液的紫红色刚好褪去时,耗0.10 mol/L的FeSO4溶液8.9毫升。已知KMnO4溶液和草酸、FeSO4溶液的反应可表示为(未配平):
MnO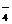 +H2C2O4+H+®CO2+Mn2++H2O MnO
+H2C2O4+H+®CO2+Mn2++H2O MnO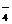 +Fe2++H+®Fe3++Mn2++H2O
+Fe2++H+®Fe3++Mn2++H2O
求血样中钙离子的含量(以100毫升血液中含钙离子多少克表示)。
28. (8分)在20℃时,有批pH值为x(x£6)的盐酸和pH值为y(y³8)的NaOH溶液,取Vx升该盐酸同该NaOH溶液中和,需Vy升NaOH溶液
(1)若x+y=14时,则Vx / Vy =
(2)若x+y=13时,则Vx / Vy=
(3)若x+y>14时,则Vx / Vy= (表达式),且Vx Vy(填<、>或=)
27. (11分)(1)在容量为50毫升的锥形瓶中放入一定量的NH4Cl晶体,用适量的水配成约20毫升饱和NH4Cl溶液。然后向溶液中投入少量镁粉,使其充分反应。
①试分析本实验可观察到的现象:
;
②写出有关离子方程式:
。
(2)已知液体SO2和纯水的导电性相近,都能在一定程度上电离:2SO2 SO2++SO
SO2++SO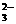 ,在液态SO2中可用Cs2SO3去滴定SOCl2 ,发生的反应方程式为:
,在液态SO2中可用Cs2SO3去滴定SOCl2 ,发生的反应方程式为:
。
26.(10分)科学家从化肥厂生产的(NH4)2SO4中检验出组成为N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO42-和N4H44+两种形式存在,植物的根系极易吸收N4H44+,但它遇到碱时,会生成一种形似白磷的N4分子,N4不能被植物吸收。
请回答下列问题:
(1)N4和N2的关系正确的是 (填序号)
A.同种单质 B.同位素 C.同分异构体 D.同素异形体
(2)N4H4(SO4)2 (填“能”或“不能”)与草木灰混合使用。
(3)已知液氨中存在着平衡:2NH3 NH4++NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式
NH4++NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式
(4)含有一定量(NH4)2SO4和NH3·H2O的水溶液称为“缓冲溶液”在此溶液中加入少
量的强酸或者强碱时,溶液的 pH几乎不变,这可由下列离子方程式来说明。
加酸时:NH3·H2O + H+ = NH4+ + H2O
加碱时:NH4+ + OH- = NH3·H2O
由于(NH4)2SO4和NH3·H2O的大量存在,加少量酸或碱时,溶液中c(H+)与c(OH-)基本保持不变;含有一定量NaH2PO4和Na2HPO4的溶液,也具有缓冲作用,写出此溶液中加入少量强酸或者强碱时发生的离子反应方程式:
加酸时: ;
加碱时: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com