
题目列表(包括答案和解析)
16、用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液加入0.2mol CuO,恰好恢复到电解前的浓度和pH。则电解过程中转移电子的物质的量为 ( )
A.0.1mol B.0.2mol C.0.3mo1 D.0.4mol
15、高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn+2K2FeO4+8H2O===3Zn(OH)2+2Fe(OH)3+4KOH下列叙述不正确的是
A.放电时负极反应为:3Zn -6e-+6OH- == 3Zn(OH)2
B.放电时正极反应为:2FeO42-+6e-+8H2O===2Fe(OH)3+10OH-
C.放电时每转移3mol电子,正极有1mol K2FeO4被氧化
D.放电时正极附近溶液的碱性减弱
14、下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关 说法中不正确的是 ( )

A.该能量转化系统中的水可以循环使用
B.燃料电池系统产生的能量实际上来自于水
C.水电解系统中的阳极反应:4OH-- 4e- 2H2O + O2
2H2O + O2
D.燃料电池放电时的负极反应:H2
- 2e- + 2OH- 2H2O
2H2O
13、周期表中有些元素有“对角线相似”现象(即周期表中处于对角线位置的两元素性质相似), 如Li、Mg;Be、Al;B、Si等两两性质相似。现用熔融LiCl电解的方法可得锂和氯气。若用 已潮解的LiCl加热蒸干并可热至熔融,再用惰性电极电解,结果得到金属锂和一种无色无味的气体。据此,下列说法正确的是 ( )
A.无色无味为电解生成的锂与水反应放出的氢气
B.电解前LiCl加热时已发生水解
C.电解时产生的无色气体是氧气
D.无色气体是阳极放出的Cl2与水作用生成
12、将羧酸的碱金属盐电解可生成烃类化合物,例如: 2CH3COOK
+ 2H2O CH3-CH3↑+
2CO2↑+H2↑+2KOH,现充分电解CH2Cl-COOK水溶液,并加热电解后的水溶液,则下列说法中合理的是
(
)
CH3-CH3↑+
2CO2↑+H2↑+2KOH,现充分电解CH2Cl-COOK水溶液,并加热电解后的水溶液,则下列说法中合理的是
(
)
A.在阴极放出的气体是CO2 B.加热后有不溶于水的油状物生成
C.混合液蒸干后得到的固体是KOH D.混合液蒸干后得到的固体是KCl
11、用石墨电极电解500mLNaNO3和Cu(NO3)2的混合溶液。通电一段时间后,阴、阳两极逸出的气体在标准状况下的体积分别为11.2L和8.4L,求原溶液中Cu2+的物质的量浓度(假设溶液的体积不变) ( )
A.1.25 mol·L-1 B.2.5 mol·L-1 C.0.50 mol·L-1 D.1.0 mol·L-1
10、 电脑右图是2004年批量生产的笔记本电脑所用的甲醇燃
料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为2CH3OH +3O2 2CO2+
4H2O。下列说法正确的是
( )
电脑右图是2004年批量生产的笔记本电脑所用的甲醇燃
料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为2CH3OH +3O2 2CO2+
4H2O。下列说法正确的是
( )
 A.左电极为电池的负极,a处通入的物质是甲醇
A.左电极为电池的负极,a处通入的物质是甲醇
B.右电极为电池的负极,b处通入的物质是空气
 C.负极反应式为:CH3OH
+ H2O-6e- CO2 + 6H+
C.负极反应式为:CH3OH
+ H2O-6e- CO2 + 6H+
 D.正极反应式为:O2
+ 2H2O + 4e- 4OH-
D.正极反应式为:O2
+ 2H2O + 4e- 4OH-
9、某学生设计了一种电解法制取Fe(OH)2的实验装置。通电后,溶液中产生大量白色沉淀,且较长时间不变色。下列说法中正确的是 ( )
A.电源中的a为正极,b为负极
B.不能使用NaCl溶液作电解液
C.A、B两端都必须使用铁作电极
D.B电极发生的反应为2H2O + 2e- = H2↑+ 2OH-
8、某甲烷-氧气燃料电池的结构如右下图所示,该电池的两个电极均由多孔碳制成,以30%KOH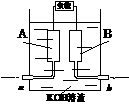 溶液为电解质溶液,气体由多孔碳孔隙逸出并在电极表面放电,其总反应的化学方程式为:CH4 + 2O2 + 2KOH
溶液为电解质溶液,气体由多孔碳孔隙逸出并在电极表面放电,其总反应的化学方程式为:CH4 + 2O2 + 2KOH K2CO3 + 3H2O。下列说法中正确的是 ( )
K2CO3 + 3H2O。下列说法中正确的是 ( )
A.用多孔碳作电极,是为了增大气体与溶液的接触面积,加快气体的放电速率
B.若b处通入的气体为氧气,则B极为负极
C.当发生反应的O2为5.6L(标准状况)时,则有2mol电子发生转移
D.正极的电极反应为CH4
+ 10OH--8e- CO32- + 7H2O,放电一段时间后该极附近溶液 的pH降低
CO32- + 7H2O,放电一段时间后该极附近溶液 的pH降低
7、某溶液中含有两种溶质NaCl和H2SO4,它们的物质的量之比为31。用石墨作电极电解该混合溶液中,其电极产物可明显分为三个阶段。下列叙述不正确的是 ( )
A.阴极自始至终只析出H2 B.阳极先析出Cl2,后析出O2
C.电解最后阶段为电解水 D.溶液pH不断增大,最后为7
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com