
题目列表(包括答案和解析)
4.下列各组离子在指定溶液中能大量共存的是 ( )
①无色溶液中:K+、Cu2+、Na+、MnO4-、SO42-
②使pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
③加入Al能放出H2的溶液中:Cl-、HCO3-、NO3-、NH4+
④在由水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+、Ba2+、Cl-、I-
⑤能使pH试纸变为蓝色的溶液:Na+、C1-、S2-、SO32-
⑥酸性溶液中:Fe2+、Al3+、NO3-、I-、Cl-
A.①②⑤ B.①③⑥ C.②④⑤ D.①②④
3.最近有人用一种称为“超酸”化合物[H(CB11H6Cl6)]和C60反应,使C60获得一个质子,得到一种新型离子化合物[HC60]+[CB11H6Cl6]-。这个反应跟下列哪一个化学反
应最相似( )
A. HCl + NH3 = NH4Cl B.SO3 + H2O = H2SO4
C. CH2=CH2 + HCl→ CH3CH2Cl D.2Na + Cl2 点燃 2NaCl
2.右图为“嫦娥一号”绕月卫星传回的第一张月面图像。我国探月的目的之一是探测月球土壤厚度和3He的资源量。3He是最安全最清洁的能源,地球上仅有15 t左右,而月球上的3He估计在1.0×106 t~1.5×106 t。 下列关于3He的说法错误的是( )
A.核内有2个质子 B.与4He互为同位素 C.核内有1个中子 D.是4He的同素异形体
1.2007年9月1日,经国务院批准,国家发改委、中宣部等十七个部委在人民大会堂举行“节能减排全民行动”启动仪式,要求在全国范围内形成全民节能减排氛围。下列有关做法不符合这一要求的是( )
|
B.在汽车上安装汽车尾气催化转化装置,使之发生如下反应:2CO+2NO 2CO2+N2
C.在大力推广乙醇汽油的同时,研究开发太阳能汽车和氢燃料电池汽车
 D.在水力发电、火力发电、核能发电和风力发电中,要大力发展火力发电
D.在水力发电、火力发电、核能发电和风力发电中,要大力发展火力发电
22、目前世界上比较先进的电解制碱术是离子交换膜法。试回答下列问题:
(1)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙、Ca2+、Mg2+、Fe3+、SO42-杂质,不符合电解要求,因此必须经过精制。
除去SO42-可用钡试剂,该钡试剂可以是 。(选填a、b、c)
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(2)现有200mL食盐水,其中含有少量的NaOH,该溶液的pH等于10,用石墨电极电解,当阴极产生的气体体积为0.224L(标准状况)时停止电解。
阳极的电极反应式为 。
电解后溶液的pH约为(忽略溶液的体积变化) 。
21、反应①②是重要的化工反应,D、E、F、G为单质,D、E、G、H为气体,且只有E为有色气
体,F是常见的金属单质,G是空气中主要成分之一,K是白色胶状沉淀,C的焰色反应为黄色,其物质间的转化关系如下,虚框内是需设计的内容,反应物只能用A-J中的物质:
(1)A的电子式 , H的结构式是 ;
(2)A溶液的电解方程式是 ;
C+B→J的离子方程式是 ;
 (3)请设计F→K的最佳途径
(3)请设计F→K的最佳途径
(4)按设计得到1mol K,电解B时转移的电子数目是 ,至少需要另加试剂的物质的量是
: mol, : mol, : mol(可不填满)。
20、已知B、C、D、K都是气体单质,物质A的焰色呈黄色,I为4核10电子中性分子,各有关物质之间的相互反应转化关系如下图所示,反应①--⑤ 都是用于工业生产的反应。

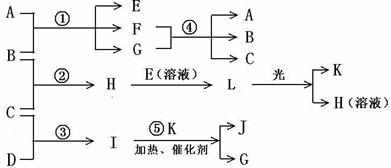
请填写下列空白:
(1)写出下列物质的化学式:B ,J 。
(2)写出下列反应的离子反应方程式:
H+E(溶液)→L ;
F+G →A+B+C 。
(3)若I与E以物质的量比1:2反应,得到F、G和二元素六核化合物M,则M的电子式是
。
(4) 反应④用于工业生产时目前采用如图示装置,该装置的优点有:
① ;
② 。
(5) 如图示装置(溶液体积为100mL), 其阴极的电极方程式是 , 标况下,当电极上产生112mL B气体时(假设气体完全逸出,溶液体积不变),烧杯中溶液的pH= 。
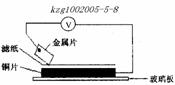
19、将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如图所示)。在每次实验时,记录电压表指针的移动方向和电压表的读数如下:
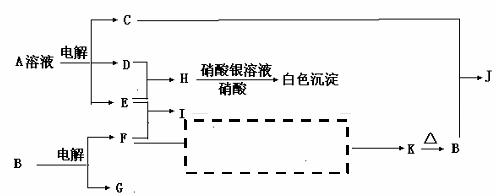 已知:构成两电极的金属的金属活泼性相差越大,电压表的读数越大。
已知:构成两电极的金属的金属活泼性相差越大,电压表的读数越大。
|
金属 |
电子流动方向 |
电压(V) |
|
A |
A→Cu |
+0.78 |
|
B |
Cu→B |
-0.15 |
|
C |
C→Cu |
+1.35 |
|
D |
D→Cu |
+0.30 |
请依据表中数据判断:
(1)__________金属可能是最强的还原剂;__________金属一定不能从硫酸铜溶液中置换出铜。
(2)若滤纸不用盐溶液浸润而改用NaOH溶液浸润,则在滤纸上看到析出蓝色沉淀的是_________________(填字母)金属。其对应的原电池的电极反应式为:负极________,正极_____________。
18、(15分) 铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
正极反应 ,负极反应 。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:
。
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+ Fe2+ Cu2+ |
1.9 7.0 4.7 |
3.2 9.0 6.7 |
|
提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu |
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。
有关反应的化学方程式 、
劣质不锈钢腐蚀的实验现象: 。
17、CuI是一种不溶于水的白色固体,它可以由反应:2Cu2++4I-=2CuI↓+I2而得到。现以石墨为阴极,以Cu为阳极电解KI溶液,通电前向电解液中加入少量酚酞和淀粉溶液。电解开始不久,阴极区溶液呈红色,而阳极区溶液呈蓝色。对阳极区溶液呈蓝色的正确解释是 ( )
A.2I--2e-=I2 碘遇淀粉变蓝
B.Cu-2e-=Cu2+ Cu2+ 显蓝色
C.2Cu+4I--4e-=2CuI↓+I2 碘遇淀粉变蓝
D.4OH――4e-=2H2O+O2 O2将I-氧化为I2,碘遇淀粉变蓝
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
|
|
|
|
|
|
|
|
|
|
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
|
|
|
|
|
|
|
|
|
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com