
题目列表(包括答案和解析)
10.(07年山东潍坊二模)在元素周期表中,一稀有气体元素原子的最外层电子构型为4s24p6,与其同周期的A、B、C、D四种元素,它们的原子的最外层电子数依次为2、2、1、7,其中A、C两元素原子的次外层电子数为8,B、D两元素原子的次外层电子数为18,E、D两元素处于同族,且在该族元素中,E的气态氢化物的沸点最高。
(1)B元素在周期表中的位置 。
(2)E的气态的氢化物在同族元素中沸点最同的原因是 。
(3)A、C两元素第一电离能 > 。(填元素符号)
(4)B元素能形成多种配全物。元素之间形成配合物的条件是:一方是能够提供孤对电子的原子,另一方是 的原子。
9.(07年广东肇庆一模)已知A、B、C、D、E五种元素都是元素周期表中前20号元素,原子序数依次增大,E的特征电子排布式为4s2。A、B、C、D四种元素在元素周期表中的相对位置如下表所示。
|
|
|
|
|
…… |
|
A |
|
|
B |
|
C |
|
|
D |
|
根据以上信息,回答下列问题:
(1)元素C在元素周期表中的位置是 周期 族;D的电子排布式为: 。
(2)A和D的氢化物中,沸点较高的是 ,原因是
;A和B的离子中,半径较小的是 (填离子符号)。
 (3)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如右图所示(阳离子用“●”表示,位于该正方体的顶点或面心;阴离子用“〇”表示,均位于小正方体中心)。该化合物的电子式是
。
(3)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如右图所示(阳离子用“●”表示,位于该正方体的顶点或面心;阴离子用“〇”表示,均位于小正方体中心)。该化合物的电子式是
。
(4)A和E化合物的晶胞1/8的体积为2.0×10-23cm3,求A和E组成的离子化合物的密度,请列式并计算(结果保留一位小数):_______________________________。
8.(07年泰安二轮质量检测)A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大。B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族。B、C、D的最高价氧化物的水化物均能互相发生反应生成盐和水。A和E可形成离子化合物,其晶胞结构如下图所示。

(1)D元素原子的价电子排布式是 ;
(2)A、B、C、D四种元素的原子半径由小到大的顺序为 (用元素符号表示);
(3)A和D的氢化物中,后者沸点较低,原因是 ;
(4)A和E的化合物晶体中,每个阳离子周围与它最近且距离相等的阳离子共有 个;
(5)已知A和E所形成化合物晶体的晶胞体积为1.6×10-22cm3,则A和E组成的化合物晶体的密度为 (结果保留一位小数)。
7.(07年烟台适应性练习)下表由元素周期表的前三周期去掉副族上方空区域后组合而成,表中虚线处为IIA、IIIA族的连接处。请用相应的化学用语回答下列问题:
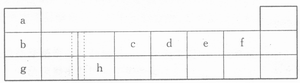
(1)h的单质能与g元素的最高价氧化物对应的水化物的溶液反应,请写出该反应的离子方程式___________________________________.

(2)上左图是第三周期8种元素按单质熔点(℃)大小顺序绘制的柱形图(已知柱形“1”代表Ar),则其中序列“2”原子的结构示意简图为________,“8”原子的电子排布式为_________。
(3)上右图是b、c、d、e、f的氢化物的沸点直角坐标图,序列“5”氢化物的化学式为____,序列“1”的氢化物的电子式:________。
(4)单质a和单质e可以设计为新型燃料电池,电解质为KOH溶液,则单质a在该燃料电池的_________极发生电极反应,电极反应式为____________。
6.(07年淄博三模)A、B、C是原子序数依次递增的短周期元素,A元素原子的电子总数等于其基态电子层数,B元素原子的价电子结构为nsnnpn,C元素的第一电离能在同族元素中最大,并且高于同周期左右相邻的元素,但其单质的熔点却低于同周期左右相邻元素的单质,D的价电子结构为3d64s2。请回答:
(1)D元素较稳定的化合价是 。
(2)C与A形成的最简单分子是 分子(填:“极性”或“非极性”),该分子再与A+元素结合成离子时,ACA键的键角发生改变,其原因是
(3)在烃中,若要求所有的原子都有可能在同一个平面中,则对碳原子成键轨道的要求是:
(4)在金刚石晶体的一个晶胞(如图1)中,含有 个碳原子。在二氧化硅晶体的一个晶胞中,含有 个化学键。原子晶体能否形成最密堆积结构,原因是
(5)铁晶体的晶胞结构(如图2):若铁原子的半径是r cm,则铁的密度是 。

5.(07年山东淄博二模)据最新一期的《新科学》杂志报道,科研人员在20℃、1个大气压和其它一定的实验条件下,给水施加一个弱电场,水就可以结成冰,称为“热冰”。下图是水和“热冰"微观结构的计算机模拟图。回答:

(1)以上信息体现了水分子具有 性,水分子中氧原子的杂化方式为 。
(2)参照热冰的图示,以一个水分子为中心,画出水分子间最基本的连接方式(用结构式表示)。
(3)固体二氧化碳外形似冰,受热气化无液体产生,俗称“干冰”。根据下图干冰的晶胞的结构回答:

①一个晶胞中有 个二氧化碳分子;在二氧化碳分子中所含的化学键类型与数目有 ;在干冰中CO2的配位数是 。
②其堆积方式与干冰晶胞类型相同的金属有(答一种即可) ,其空间利用率为 。
4.(07年山东淄博一模)A、B、C、D分别代表四种不同的短周期元素。A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的P亚层中有3个电子。
(1)C原子的电子排布式为 ,若A元素的原子最外层电子排布为1s1,则按原子轨道的重迭方式,A与C形成的化合物中的共价键属于 键。
(2)当n=2时,B的原子结构示意图为 ,B与C形成的晶体属于 晶体。当n=3时,B与C形成的晶体中微粒间的作用力是
(3)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,元素A在周期表中的位置是 ,A、B、C、D四种元素的第一电离能由大到小的顺序是 (用元素符号表示)。
3.(07年年海南化学)A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为 ;
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为 ,C的元素符号为 ;
(3)D元素的正三价离子的3d亚层为半充满,D的元素符号为 ,其基态原子的电子排布式为 。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为 ,其基态原子的电子排布式为 。
2.(07年宁夏理综)已知A、B、C、D和E 5种分子所含原子数目依次为1、2、3、4和6,且都含有18个电子。又知B、C和D是由两种元素的原子组成。请回答
(1)组成A分子的原子的核外电子排布式是 ;
(2)B和C的分子式分别是 和 ;C分子的立体结构呈 型,该分子属于 分子(填“极性”或“非极性”);
(3)若向D的稀溶液中加入少量二氧化锰,有无色气体生成。则D的分子式是 ,该反应的化学方程式为 ;
(4)若将1mol E在氧气中完全燃烧,只生成1mol CO2和2molH2O,则E的分子式是 。
1.(07年山东理综)请完成下列各题:
(1)前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有 种。
(2)第ⅢA、ⅤA原元素组马的化合物CaN、CaP、CaAs等是人工合成的平等体材料,其晶体结构与单晶硅相似,Ca原子的电子排布式为 。在CaN晶体中,每个Ca原子与 个N原子相连,与同一个Ca原子相连的N原子构成的空间构型为 。在四大晶体类型中,CaN属于 晶体。
(3)在极性分子NCl3中,N原子的化合物为―3,Cl原子的化合价为+1,请推测NCl3水解的主要产物是 (填化学式)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com