
题目列表(包括答案和解析)
1.下列关于物质的量的叙述中,错误的是( )
A.0.012 Kg 12C 中含有约 6.02×1023 个碳原子
B.1 mol SO2 在标准状况下的体积约为 22.4 L
C.1 mol 水中含有 2 mol 氢和 1 mol 氧
D.1 mol Ne 含有约 6.02×1024 个电子
15、现有部分短周期元素的性质或原子结构如下表:
|
元素编号 |
元素性质或原子结构 |
|
T |
M层上有2对成对电子 |
|
X |
最外层电子数是次外层电子数的2倍 |
|
Y |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
|
Z |
元素最高正价是+7价 |
(1)元素T的原子最外层共有 种不同运动状态的电子。元素X的一种同位素可测定文物年代,这种同位素的符号是
(2)元素Y与氢元素形成一种离子YH4+,写出该微粒的电子式 (用元素符号表示)
(3)元素Z与元素T相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是
a 常温下Z的单质和T的单质状态不同 b Z的氢化物比T的氢化物稳定
c 一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是 ,理由是 。
14、A、B、C、D、E都是短周期元素,原子序数依次增大,B、C同周期,C的非金属性最强,A、D同主族隔周期,E元素原子最外层的p亚层电子数是s亚层电子数的一半。A、B能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1。根据以上信息回答下列问题:
⑴甲、乙两分子中含有非极性共价键的物质的电子式是________________ ,
C元素在周期表中的位置是__________________。
⑵C和D的离子中,半径较小的是__________(填离子符号)。
⑶将D的单质投入甲中,待D消失后再向上述溶液中加入E的单质,此时发生反应的化学方程式是_____________ ________ __ _____________
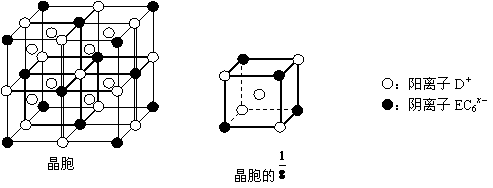
⑷C、D、E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子D+(用○表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用●表示)位于该正方体的顶点和面心。该化合物的化学式是_________ 。
(5)如图,铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化。下列说法正确的是( )
A.γ-Fe晶体中与每个铁 原子距离相等且最近的铁原子有6个
B.α-Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
C. 若δ-Fe晶胞边长为acm,α-Fe晶胞边长为bcm,则两种晶体密度比为2b3:a3
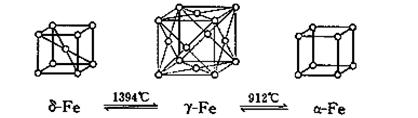 D.将铁加热到1500℃分别急速冷却和缓慢冷却,得到的晶体类型相同
D.将铁加热到1500℃分别急速冷却和缓慢冷却,得到的晶体类型相同
12、下表由元素周期表的前三周期去掉副族上方的空白区域后组合而成,表中虚线处为ⅡA、ⅢA族的连接处,请用相应的化学用语回答下列问题:
|
a |
|
|
|
|
|
|
|
|
b |
 |
 |
c |
d |
e |
f |
|
|
g |
|
h |
|
|
|
|
|
(1)写出仅由e形成的两种带有相同电荷数的阴离子的符号: 、 。
(2)d元素名称为 ,其基态原子的电子排布式为 。
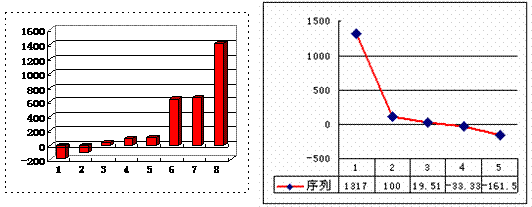
(3)上左图是表示第三周期8种元素单质的熔点(℃)柱形图,已知柱形“1”代表Ar,则其中柱形“8”代表 (填化学式),是 晶体。
(4)b、c、d、e、f的氢化物的沸点(℃)直角坐标图(上右图),序列“5”的氢化物的名称是 ,空间构型为 ;序列“2”的氢化物的结构式为 ,其中心原子的杂化轨道类型是 杂化。
11、科学家发现C60分子由60个碳原子构成,它的形状像足球(图C),含有C=C键,因此又叫足球烯。1991年科学家又发现一种碳的单质--碳纳米管,是由六边环形的碳原子构成的具有很大表面积管状大分子(图D),图A、图B分别是金刚石和石墨的结构示意图。图中小黑点或小黑圈均代表碳原子。
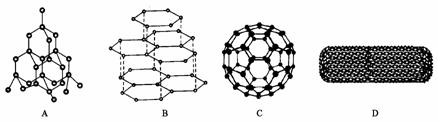
(1)金刚石、石墨、足球烯和碳纳米管四种物质互称为同素异形体,它们在物理性质上存在较大的差异,其原因是___________ _____ ;
(2)同条件下,足球烯、石墨分别和气体单质F2反应时,化学性质活泼性的比较为足球烯比石墨 (填“活泼”、“一样活泼”、“更不活泼”)理由是:______ ;
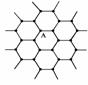
(3)由右边石墨的晶体结构俯视图可推算在石墨晶体中,每个正六边
形平均所占有的C 原子数与C-C键数之比为______ ;
(4)在金刚石的网状结构中,含有共价键形成的碳原子环、其中最小的环上有_____个碳原子(填数字),每个碳原子上的任两 个C-C键的夹角都是______ _(填角度)。
(5)燃氢汽车之所以尚未大面积推广,除较经济的制氢方法尚未完全解决外,还需解决H2的贮存问题,上述四种碳单质中有可能成为贮氢材料的是:_______ _______。
(6)下列图象是从NaCl或CsCl晶体结构图中分割出来的部分结构图,试判断NaCl晶体结构的图象是
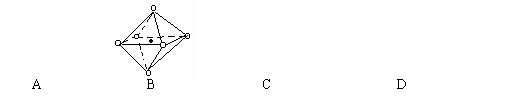

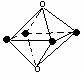
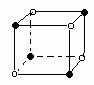
10、下图是元素周期表中的一部分,表中所列字母分别代表一种化学元素,请回答下列问题:
|
A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
B |
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
M |
D |
E |
|
|
|
F |
|
|
|
|
|
|
|
|
|
|
|
G |
|
|
H |
I |
|
|
|
|
|
|
|
N |
|
J |
|
|
|
|
|
|
|
|
|
|
|
K |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
L |
|
(1)上述所列元素的原子中,最外层电子层上只有两个电子的是________________(填“元素符号”);
(2)下列叙述正确的是_____________(填字母序号);
a.K的最高价氧化物对应的水化物是一种强碱
b.硒化氢的稳定性强于H的氢化物的热稳定性
c.F与H形成化合物水溶液的pH大于F与I形成化合物水溶液的pH,说明相同浓度氢化物水溶液的酸性H弱于I
d.MA2E分子中M原子采取SP2杂化方式
e.N的电子排布式:ls22s22p63s23p63d44s2
(3)根据VSEPR理论预测DA4+离子的空间构型 ,ME2的空间构型 ;
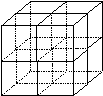
(4)元素F和元素I形成的化合物是 晶体(填晶体类型), 右图为该晶体的结构示意图,请在图中用实心球(●)和空心球(○)分别表示元素F和元素I所在位置。
(5)已知Ti3+可形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为紫色,另一为绿色,相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的2/3。
则绿色晶体的化学式为 ,该配合物中的配位体为 。
9、碳是形成化合物最多的元素,其单质与化合物广布于自然界。
⑴ 碳原子的核外电子排布式为 。与碳同周期的非金属元素N的第一电离能大于O的第一电离能,原因是 ;
⑵ CS2是一种重要的有机溶剂,CS2分子的空间构型为 ;写出一种与CS2互为等电子体的物质的化学式 ;
⑶ 冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如右图,其中空心球所示原子位于立方体的顶点或面心,实心球所示原子位于立方体内)类似。每个冰晶胞平均占有 个水分子,冰晶胞与金刚石晶胞微粒排列方式相同的原因是
.
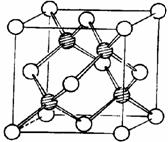
8、新型节能材料高温超导体的最先突破是在1987年
从新的钇钡铜氧材料的研究开始的。钇钡铜氧的晶胞结构如图。研究发现,此高温超导体中的铜元素有两种价态:+2价和+3价(铜元素的原子序数为29)。
(1)写出铜在周期表中的位置(周期和族)
(2)写出Cu3+的核外电子排布:
(3)根据图示晶胞结构,推算晶体中Y,Cu,Ba和O原子个数比,确定其化学式为:
。
(4)根据(3)所推出的化合物的组成及各元素的化合价 (该化合物中Y、 Ba元素的化合价分别为+3价、+2价),计算化合物中两种价态Cu原子个数比为: 。
(5)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到的[Cu(NH3)4]SO4晶体中含有的化学键除了普通共价键外,还有 和 。
7、Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
|
元 素 |
Mn |
Fe |
|
|
电离能 /kJ·mol-1 |
I1 |
717 |
759 |
|
I2 |
1509 |
1561 |
|
|
I3 |
3248 |
2957 |
回答下列问题:
⑴ Mn元素价电子层的电子排布式为 ,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。对此,你的解释是
⑵ Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。
① 与Fe原子或离子形成配合物的分子或离子应具备的结构特征是 ;
② 六氰合亚铁离子(Fe(CN)64-)中的配体CN-中C原子的杂化轨道类型是 ,写出一种与CN-互为等电子体的单质分子的路易斯结构式 ;
⑶ 三氯化铁常温下为固体,熔点282℃,沸点315℃,
在300℃以上易升华。易溶于水,也易溶于乙醚、丙酮
等有机溶剂。据此判断三氯化铁晶体为 ;
⑷ 金属铁的晶体在不同温度下有两种堆积方式,晶胞
分别如右图所示。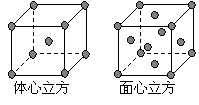 面心立方晶胞和体心立方晶胞中实际
面心立方晶胞和体心立方晶胞中实际
含有的Fe原子个数之比为 。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com