
题目列表(包括答案和解析)
25.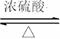 实验室用丁酸和乙醇为原料,在浓硫酸存在的条件下加热制取并分离出丁酸乙酯,反应方程式及有关信息如下:
实验室用丁酸和乙醇为原料,在浓硫酸存在的条件下加热制取并分离出丁酸乙酯,反应方程式及有关信息如下:
CH3CH2OH+CH3CH2 CH2COOH CH3CH2CH2COOC2H5+H2O
反应在该条件下进行时各物质的浓度(mol/L)随时间的变化如下表:
|
时间(min) |
CH3CH2 CH2COOH |
CH3CH2OH |
CH3CH2CH2COOC2H5 |
H2O |
|
0 |
0.3 |
0.7 |
0 |
0.3 |
|
10 |
0.23 |
a |
b |
c |
|
20 |
0.2 |
0.6 |
0.1 |
0.4 |
有关物质在101.3K Pa时沸点如下:
|
物质 |
乙醇 |
丁酸 |
丁酸乙酯 |
水 |
油 |
|
沸点(ºC) |
78.5 |
163.5 |
121-126 |
100 |
约250 |
(1) 写出该反应的平衡常数表达式K=______________________________。
能否由题给条件判断K值随温度变化是增大还是减小___________(选填“能”或“不能”)。
(2)表中,a = ____ mol/L。50℃时,K=,在20min时,反应是否达到平衡______(选填“是”或“否”)。
(3)在10~20min时,用乙醇表示的平均反应速率为_______________mol/L·min。
该反应速率比0~10min的平均反应速率小,其原因是_______________________。
(4)在起始浓度相同的情况下,要提高丁酸乙酯的产率,可采取的措施是__________________________________________________________________________。
24.市场销售的某种食用精制盐包装袋上有如下说明:
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)
KIO3+ KI+ H2SO4→ K2SO4+ I2+ H2O
(2)反应中若产生0.12 mol I2 ,则转移电子的物质的量是 mol。
(3)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是 。
②回收四氯化碳的操作名称是: 。
23.(B)下表是元素周期表
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
① |
|
② |
|
|
|
③ |
|
|
|
|
|
|
|
|
|
|
④ |
⑤ |
|
⑥ |
⑦ |
⑧ |
|
⑨ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
⑩ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)⑤的元素符号是______;在上述周期表用元素符号标出铁元素所在的位置。
(2)表中最活泼的金属是______,非金属性最强的元素是______;(填写元素符号)
(3)表中能形成两性氢氧化物的元素是_______,分别写出该元素的氢氧化物与⑨的最高价氧化物对应水化物反应的化学方程式: __________________________________________;
(4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱: ______________________________________________________________________。
|
产品标准 |
GB5461 |
|
产品等级 |
一级 |
|
配 料 |
食盐、碘酸钾、抗结剂 |
|
碘含量(以I计) |
20~50mg/kg |
|
分装时期 |
|
|
分装企业 |
|
23.(A)下图为周期表中前四周期的表格。
甲是中学化学中常见的化合物,其化学式为XCl3 。
(1)请根据中学化学中常见的化合物,将X代表的元素符号填在上面周期表格中对应的位置,已知每摩尔XCl3的电子数为59-83摩尔(要求写出3种)。
(2)若一种XCl3晶体的熔点为-91℃,沸点为75℃,它属于____________(填“原子”、“离子”或“分子”)晶体。
(3)若将一种XCl3水溶液蒸干、灼烧,得到红棕色粉末X2O3,则含碳的X合金在潮湿的空气中发生电化学腐蚀时,正极的电极反应式是____________________________________。
(4)若X代表上述三种元素中的一种组成的金属单质,该单质可与(3)中所述粉末发生置换反应,该反应化学方程式是_______________________________________________。
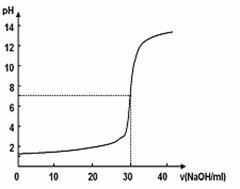
22.如图所示,10mL物质的量浓度为x mol/L的盐酸,用物质的量浓度为y mol/L的NaOH溶液滴定的图示。依据图示推出x和y的物质的量浓度是( )
|
|
A |
B |
C |
D |
|
x (mol/L) |
0.12 |
0.04 |
0.03 |
0.09 |
|
y(mol/L) |
0.04 |
0.12 |
0.09 |
0.03 |
第II卷(共84分)
21.向0.1mol/L氨水中逐渐加入一定量的水,始终保持增大趋势的是( )
A.H+的浓度 B.OH -的浓度
 C.NH4+ 的数目 D.NH4+的浓度
C.NH4+ 的数目 D.NH4+的浓度
20.以NA表示阿伏加德罗常数,下列说法正确的是( )
A.0.1molH3O+中含有NA个电子
B.标准状况下,11.2L臭氧中含有NA个氧原子
C.2g重氧水(2H218O)含有NA个中子
D.84gNaHC03晶体中含有NA个CO32-
19.新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化。某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式为:
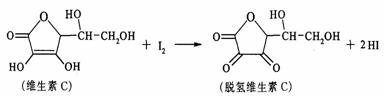
下列说法正确的是( )
A.上述反应为取代反应
B.滴定时可用淀粉溶液作指示剂
C.滴定时应剧烈振荡锥形瓶
D. 脱氢维生素C的分子式为C6H6O6
18.如图所示,集气瓶内充满某恰当比例的混合气体,置于光亮处,一段时间后,将滴管内的水挤入集气瓶,烧杯中的水会进入集气瓶,集气瓶内气体是( )
A.CO、O2 B.Cl2、CH4 C.NO2、O2 D.N2、H2
17. 用下列实验装置完成对应的实验(部分仪器巳省略),能达到实验目的的是( )

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com