
题目列表(包括答案和解析)
8.有下列四组物质,如果把某组物质中的后者逐滴加入到前者中至过量,将出现“先产生白色沉淀,后白色沉淀溶解”的现象,这组物质是
A. 稀硫酸、氯化钡溶液 B. 硫酸亚铁溶液、氢氧化钠溶液
C. 氯化钠溶液、硝酸银溶液 D. 氯化铝溶液、氢氧化钠溶液
7.往一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g) 2HI(g);△H>O,当达到平衡后,t0时改变反应的某一条件(混合气体物质的量不变),且造成容器内压强增大,下列说法正确的是
2HI(g);△H>O,当达到平衡后,t0时改变反应的某一条件(混合气体物质的量不变),且造成容器内压强增大,下列说法正确的是
 A.容器内气体颜色变深,平均分子量不变
A.容器内气体颜色变深,平均分子量不变
B.平衡不移动,混合气体密度增大
C.H2转化率增大,HI平衡浓度变小
D.改变条件前后,速度图象为(如右图)
6.下列各组离子中,在溶液中能够大量共存的一组是
A.A1O2-、SO42-、Cl-、K+ B.Al3+、Ca2+、HCO3-、Na+
C.Fe3+、NH4+、SO42-、SCN- D. H+、C1-、Na+、H PO42-
5.设NA代表阿伏加德罗常数,下列说法中正确的是
①常温常压下,17g甲基(一CH3)所含的中子数为9NA
②常温常压下,22.4LNO气体的分子数小于NA
③64g铜发生氧化还原反应,一定失去2NA个电子
④常温常压下,100mL0.5mol/L的乙酸溶液中,乙酸的分子数目小于0.05NA
⑤标准状况下,22.4L二氯甲烷所含有的分子数为4NA
⑥常温常压下,lmol氦气含有的核外电子数为4NA
A.①② B.③④ C.②④ D.⑤⑥
4.《Inorganic Syntheses》(无机合成)一书中,有一如下图所示的装置,用以制备某种干燥的纯净气体。该装置中所装的药品正确的是
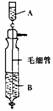 A.A中装浓硫酸,B中装浓盐酸
A.A中装浓硫酸,B中装浓盐酸
B.A中装浓盐酸,B中装浓硫酸
c.A中装氢氧化钠浓溶液,B中装浓氨水
D.A中装浓氨水,B中装氢氧化钠浓溶液
3.下列叙述不正确的是
A.硝酸银溶液通常保存在棕色的试剂瓶中,是因为硝酸银见光易分解
B.乙醇的沸点比甲醚(CH3OCH3)高,主要原因是乙醇分子间能形成氢键
C.反应AgCl+NaBr=AgBr+NaCl能在水溶液中进行,因为AgBr比AgCl更难溶于水
D. 常温下浓硫酸可贮存于铁制或铝制容器中,说明常温下铁和铝与浓硫酸不反应
2.正电子、负电子等都属于反粒子,它们跟普通电子、质子的质量、电量均相等,电性相反。科学家设想在宇宙的某些部分可能存在完全由反粒子构成的物质----反物质。1997年年初和年底,欧洲和美国的科研机构先后宣布:他们分别制造出9个和7个反氢原子,这是人类探索反物质的一大进步。你推测反氢原子的结构是:
A.由1 个带正电荷的质子与一个带负电荷的电子构成
B.由1 个带负电荷的质子与一个带正电荷的电子构成
C.由1 个不带电的中子与一个带负电荷的电子构成
D.由1 个带负电荷的质子与一个带负电荷的电子构成
1.下列解释不科学的是
A.“水滴石穿”主要是溶解了CO2的雨水与CaCO3长期作用生成了可溶性的Ca(HCO3)2的缘故。
B.长期盛放NaOH溶液的滴瓶不易打开,是因为NaOH与瓶中的CO2反应导致瓶内气
体减少形成“负压”的缘故。
C.严格地讲,“通风橱”是一种不负责任的防污染手段,因为实验产生的有害气体没有得到转化或吸收。
D.“雨后彩虹”、“海市蜃楼,’既是一种自然现象又是光学现象,也与胶体的知识有关。
23.(8分)(1)Xe和F2在一定条件下发生反应,Xe +F2 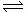 XeF2;XeF2+F2
XeF2;XeF2+F2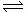 XeF4;XeF4+F2
XeF4;XeF4+F2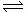 XeF6;可得XeF2、XeF4、XeF6三种气态氟化物。当压强一定,温度升高时,三种氟化物在平衡混合物中的浓度均减小。当压强为700kPa、温度达到1250℃时,测得XeF2的体积分数约为95%。那么,为了有效地制备XeF2,你认为应该采取的合适措施是
。
XeF6;可得XeF2、XeF4、XeF6三种气态氟化物。当压强一定,温度升高时,三种氟化物在平衡混合物中的浓度均减小。当压强为700kPa、温度达到1250℃时,测得XeF2的体积分数约为95%。那么,为了有效地制备XeF2,你认为应该采取的合适措施是
。
(2)据报道,在﹣55℃,将XeF4(X)和C6F5BF2(Y)化合,可得一离子化合物(Z),测得Z中Xe的质量分数为31%,阴离子为四氟硼酸根离子,阳离子结构中含有Y的苯环,Z是首例有机氙(Ⅳ)的化合物,﹣20℃以下稳定。Z为强氧化剂,如与碘反应得到五氟化碘,放出氙,同时得到Y。据此回答(要求化合物Z以离子形式表示):
①写出合成Z反应的化学方程式 。
②写出Z和碘反应的化学方程式 。
(3)英国化学家以巴特莱特将等物质的量的PtF6与Xe混合在室温下反应,制得第一个稀有气体化合物六氟合铂酸氙:Xe ﹢ PtF6 ﹦ XePtF6。该化合物极易与水反应,生成氙、氧气和铂的+4价氧化物等。已知生成物氙和氧气的物质的量之比为2﹕1、。试写出XePtF6水解反应的化学方程式 。
(4)现将二份等质量的XeF2和XeF4的混合物进行如下实验:
①一份用水处理,得到气体A和溶液B,A的体积为56.7mL(标准状况,下同),其中含O222.7mL,其余为Xe。B中的XeO3能氧化30.00mL浓度为0.1000mol∕L的(NH4)2Fe(SO4)2。(XeO3被还原为Xe)
②另一份用KI溶液处理,生成的I2用0.2000mol∕L的Na2S2O3溶液滴定,共用去35.00mL。已知反应 I2 + 2S2O32- == S4O62- + 2I- , 试求混合物中XeF2和XeF4的物质的量。
22.(8分)I.高炉炼铁中发生的基本反应之一是FeO(s)+CO(g)⇋Fe(s)+CO2(g) ΔH>0。其平衡常数可表达为k =c(CO2)/c(CO),已知1100℃时,k=0.263。
 (1)温度升高,平衡移动后达到新的平衡,高炉内CO2和CO的体积比值 (填“增大”“减小”或“不变”),平衡常数k值 (填“增大”“减小”或“不变”)。
(1)温度升高,平衡移动后达到新的平衡,高炉内CO2和CO的体积比值 (填“增大”“减小”或“不变”),平衡常数k值 (填“增大”“减小”或“不变”)。
(2)1100℃时测得高炉中c(CO2)=0.025mol∙L-1,c(CO)=0.1mol∙L-1,在这种情况下,该反应是否处于平衡状态 (填“是”或“否”)。此时,化学反应速率是v(正) v(逆)(填“>”“<”或“=”),原因是
II.如图所示,温度不变时,把某容器分割成A、B两部分,A容器 体积固定不变,B有可移动的活塞,现在A中充入2 mol
SO2和1 mol O2,在B中充入2 mol SO3和 1 mol N2,在相同条件下发生可逆反应:2 SO2(g)+O2(g)
 2 SO3(g)。根据下列要求填写空白:
2 SO3(g)。根据下列要求填写空白:
⑴固定活塞位置在3处不动,达到平衡时,设A中压强为PA , B中压强为PB,则PA与PB的关系是PA _____ PB(填“<”、“=”、“>”)。
⑵若要使A与B中平衡状态相同,可移动活塞的位置应在 处。
⑶若活塞右移到5处,达到平衡后,B中SO3为x mol,A中SO3为y mol , 则x和y 的关系是x y. (填“<”、“=”、“>”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com