
题目列表(包括答案和解析)
15.已知(1)胆矾失水反应的热化学方程式为:
CuSO4·5H2O(s)=CuSO4(s)+5H2O(l); △H=+Q1kJ/mol
(2)室温下,无水硫酸铜溶于水的热化学方程式为:
CuSO4(s)=Cu2+(aq)+SO42-(aq);△H=-Q2kJ/mol
(3)胆矾溶于水时,溶液温度降低。
则Q1与Q2的关系是(Q1、Q2为正数)
A.Q1>Q2 B.Q1=Q2 C.Q1<Q2 D.无法确定
14.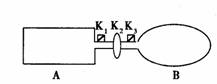 A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热保持恒压的气球。关闭K2,将少量且等量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同。
A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热保持恒压的气球。关闭K2,将少量且等量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同。
[已知:2NO2(红棕色)  N2O4(无色) ; △H<0 ] 下列说法正确的是
N2O4(无色) ; △H<0 ] 下列说法正确的是
A.一段时间后反应达到平衡,此时A、B中生成N2O4速率是v(A)> v(B)
B.若打开活塞K2,气球B将变大
C.如果将已开启的K2关闭,再向A、B中分别充入与初始量相等的NO2,则达到新平衡时,A中NO2的转化率将增大
D.保持K2关闭、室温和A、B体积都不变,将A套上一个绝热层,B与外界可以进行热传递,向真空的A、B中分别充入等量且少量的NO2,达到平衡时混合气颜色较深的是容器A
13.下列说法不正确的是
A.离子化合物一定是强电解质,共价化合物一定是弱电解质
B.电解质溶液的导电过程就是电解的过程
C.处于平衡状态的可逆反应中,若平衡向正反应方向移动,逆反应速率一定减小
D.正盐的水溶液呈酸碱性是由于水的电离平衡被破坏所造成的
12.下列离子反应方程式书写正确的是
A.向碳酸氢铵溶液中滴加过量的氢氧化钠溶液:HCO3-+OH-=CO32-+H2O
B.铜片加入稀硝酸中:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
C.1L2mol/L的FeBr2溶液中通入2.5molCl2:2Fe2++4Br-+3Cl2=6Cl-+2Fe3++2Br2
D.四氧化三铁粉末溶于足量的稀HNO3:Fe3O4+8H+=2Fe2++Fe3++4H2O
11.下列物质发生变化,因反应条件或反应物的用量不同,能够得到不同生成物的是
①SO2和Ba(OH)2溶液 ②Na和O2 ③FeBr2和Cl2 ④C2H5OH和浓H2SO4
⑤Ca(HCO3)2溶液和NaOH溶液 ⑥AlCl3溶液和KOH溶液
A.①⑥ B.①④⑥ C.除②③外 D.全部
10.设NA为阿伏加德罗常数,下列说法中正确的是
A.12.4g白磷晶体中含有的P-P键数是0.6NA
B.100g的98%的浓H2SO4中所含的氧原子数为4NA
C.1molC20H42的分子中含有的共价键数目为62NA
D.10.0mL、16mol/L的浓硫酸与足量的Cu共热,转移的电子数为0.16NA
9.将氢氧化钠、氯化钡和硫酸铝三种固体组成的混合物溶于足量的水中,充分溶解,用1mol·L-1稀硫酸滴定,加入稀硫酸的体积与生成沉淀的质量关系如图所示。下列有关判断正确的是
A.A~B段所发生反应的离子方程式是:Ba2+ + SO42- = BaSO4↓
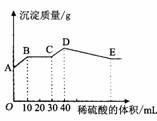 B.B~C段所发生反应的离子方程式是:H+ + OH- = H2O
B.B~C段所发生反应的离子方程式是:H+ + OH- = H2O
C.D点所表示的沉淀的化学式是: Al(OH)3、 BaSO4
D.E点所表示的溶液中:n (Na+) = n (Cl-)
8.已知NaHSO3显酸性,NaHCO3溶液显碱性,现有浓度为0.1mol/L的NaHSO3和NaHCO3溶液两种,两种溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中正确的一组是
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B.c(Na+)+c(H+)=c(RO32-)+c(OH-)+ c(HRO3-)
C.c(Na+)=c(H2RO3)+2c(RO32-)+ c(HRO3-)
D.c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
7.在90℃时,将pH=12的NaOH溶液V1 L与pH=l的H2SO4溶液V2 L混合,若所得混合溶液的pH=11,则V1∶V2为(已知:在90℃时,水的离子积为10-12)
A.2:9 B.101:9 C.9:2 D.9:101
6.右图中a、b、c、d、e、f为元素周期表中前4周期的相邻的一部分元素,下列有关叙述正确的是
|
|
|
|
|
a |
|
|
|
b |
c |
|
|
d |
e |
|
|
|
|
|
|
|
f |
|
A.b、c、e三种元素的单核离子半径大小关系:e>b>c
B.六种元素中,d元素的性质最稳定
C.c的氢化物沸点比f氢化物的沸点低
D.b元素除0价外,只有一种化合价
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com