
题目列表(包括答案和解析)
1.下列叙述正确的是( )
①A r原子的结构示意图为
②Fe、Cu的价电子排布式分别为:3d64s2 3d104s1
③Al、N原子结构中单电子数分别为:1、3
④SiO2、NaCl、S、He不能代表一个分子,不是分子式,而CO2、C60代表一个分子,是分子式
⑤在CS2、PCl3中各原子最外层均能达到8电子的稳定结构
⑥乙烯的结构简式为:CH2CH2 甲烷的最简式为:CH4
⑦21H2、11H2互为同位素,其摩尔质量分别为:4、2
⑧由两种原子组成的纯净物一定是化合物
⑨聚乙烯有固定沸点
⑩能证明氯化氢是共价化合物的是:氯化氢不易分解
A.①②③ B.①②③⑤⑦ C.①③④⑥⑦⑧⑨ D.①⑤⑦⑩
24.(8分)工业上利用焦炭在石灰窑中燃烧放热,使石灰石分解生产CO2。主要反应如下: C+O2 CO2 ① CaCO3
CO2 ① CaCO3 CO2↑+CaO ②
CO2↑+CaO ②
⑴纯净的CaCO3和焦炭混合物m g在石灰窑中完全反应,所得CO2的物质的量范围是
。
⑵纯净的CaCO3和焦炭按①②完全反应,当窑内配比率
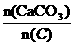 =2.20时,窑气中CO2的最大体积分数为多少?(设空气只含N2与O2,且体积比为4∶1。计算结果保留3位有效数字。下同)
=2.20时,窑气中CO2的最大体积分数为多少?(设空气只含N2与O2,且体积比为4∶1。计算结果保留3位有效数字。下同)
⑶某次窑气成分(按体积分数计)如下:O2 0.2%,CO 0.2%,CO2 41.6%,其余为N2。则此次窑内配比率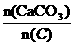 为何值?
为何值?
23.(6分)某石墨回收厂,为将回收的石墨棒处理成疏松状的碳粉,采用浓硫酸蒸煮废石墨棒的落后生产工艺,这种落后工艺所造成的恶劣后果是排入水体的废酸液导致严重环境污染。试完成下列问题:
⑴写出用浓硫酸蒸煮石墨发生的化学方程式。这种方法除废酸污染水体外,还将对大气有什么危害?。
⑵ 该厂每天向附近溪水中排放400吨废酸液,某环保组测得该溪水中污染指数如下:
|
pH值 |
水中悬浮物(mg/L) |
氟化物(mg/L) |
化学需氧量(CODmg/L) |
|
1.8 |
7143 |
3100 |
2670 |
以上数据表明氟化物是国家规定允许排放标准的310倍,COD是国家规定允许排放标准260倍。为净化这条溪水,除责令该厂停产整顿外,主管部门决定,建在这条溪水上游的某水库开闸放水以稀释污染物。请计算上游水库排放的流量应为每秒多少立方米时才能使该溪水中氟化物、COD指标达到国家规定允许排放标准? (设废酸液密度为1 g/cm3,计算结果精确到0.01)
22. (10分)将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g) 2SO3(g),△H﹤0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1 mol。试回答下列问题:
2SO3(g),△H﹤0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1 mol。试回答下列问题:
⑴反应进行到t1时,SO2的体积分数为 。
⑵若在t1时充入一定量的氩气(Ar),SO2的物 质的量将 (填“增大”、“减小”或“不变”)。
⑶若在t1时升温,重新达到平衡状态,新平衡混合物中气体的总物质的量 2.1mol(填“<”、“>”或“=”),并简单说明原因 .
⑷若其它条件不变,在t1时再加入0.2molSO2、0.1molO2 和1.8molSO3,在图中作从t0→t1→t2这段时间内SO2的物质的量变化曲线。

21.(8分) (1)室温下,pH=2的硫酸氢钠溶液中滴入等体积的pH=12的Ba(OH)2溶液后,所发生反应的离子方程式为 。
(2)室温下取0.2mol·L-1HCl溶液与0.2mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
① 混合溶液中水电离出的c(H+) 0.2mol·L-1 HCl溶液中水电离出的c(H+)(填“>”、“<”、或“=”)。
② 求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-) - c(M+) = mol·L-1
c(H+) - c(MOH) = mol·L-1
20.(10分)钨是我国丰产元素。自然界钨主要以钨(+6)酸盐的形式存在。黑钨矿的主要成分是铁和锰的钨酸盐(FeWO4、MnWO4)。黑钨矿传统冶炼工艺流程图如下:

⑴已知上述转化中W的化合价未发生变化,则产品C的化学式 ;如何将其冶炼成单质(用化学方程式表示) 。根据金属的活动性不同,金属的冶炼方法一般有 三种。
⑵写出第一步转化中“Mn2+→MnO2”的离子方程式 。
⑶我国钨化学研究的奠基人顾翼东先生采用另外的反应制得了一种蓝色的、非整比的钨氧化物WO3-x。这种蓝色氧化钨具有比表面大、易还原的优点。一般认为,蓝色氧化钨的颜色和非整比暗示了在化合物中存在五价和六价两种价态的钨。已知x的值0.1,则蓝色氧化钨中这两种价态的钨原子数之比为 。
19. (10分)有常见A、B、C三种短周期元素,它们的原子序数逐渐增大,B元素原子最外层电子数是C元素原子最外层电子数的一半,A元素最外层电子数比B多一个。甲、乙、丙是3种含氧酸的钠盐,甲中含B元素,乙中含C元素,丙中含A元素,甲、丙溶液pH>7,乙溶液pH<7;丁为气体,戊为淡黄色固体。甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如下图:
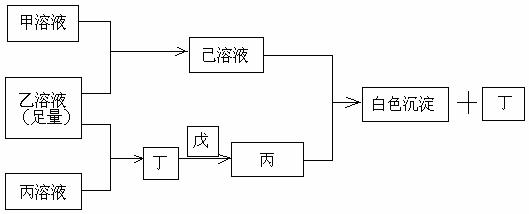
请回答:
(1)写出C元素的原子结构示意图__ ___,戊的电子式________;
(2)用有关化学用语解释:丙溶液呈碱性的原因____________________________;
(3)写出有关反应的离子方程式:
①甲溶液+乙溶液(足量)→己溶液________;②乙溶液+丙溶液→丁____________。
18.(16分)为了证明在实验室制备Cl2的过程中会有水蒸气和HCl挥发出来,甲同学设计了如下图所示的实验装置,按要求回答问题。
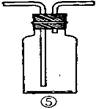

⑴请根据甲同学的意图,连接相应的装置,接口顺序:
b接 接a。
⑵U形管中所盛试剂的化学式为 。
⑶装置③中CCl4的作用是 。
⑷乙同学认为甲同学实验有缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加装置⑤。你认为装置⑤应加在
之间(填装置序号)。瓶中可以放入 。
⑸丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成其他溶液。你认为可将溶液换成 ,如果观察到 的现象,则证明制Cl2时有HCl挥发出来。
17.(4分)下列有关实验的叙述中,合理的是 ( 多选倒扣分)
A.用碱式滴定管量取25.00mL溴水
B.不宜用瓷坩埚烧氢氧化钠或碳酸钠
C.蒸馏石油时,加热一段时间后发现未加碎瓷片,立刻拔开橡皮塞并投入碎瓷片
D.圆底烧瓶、锥形瓶、蒸发皿加热时都应垫在石棉网上
E.使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏高
F.测定胆矾结晶水含量时,加热后无水硫酸铜粉末表面发黑,会使测定结果偏高
G.为了提高纯锌与稀硫酸反应的速率,可向稀硫酸中滴入几滴CuSO4溶液
H.中和热测定实验,用铜质搅拌棒代替环形玻璃搅拌棒,所测得的中和热数值偏高
G.各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘纸上称量
I. 用碱式滴定管量取20.00 mL 0.10mol/L KMnO4溶液
16.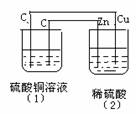 如图的装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后测得导线上通过了0.02mole-。若不考虑溶液体积变化,下列叙述正确的是
如图的装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后测得导线上通过了0.02mole-。若不考虑溶液体积变化,下列叙述正确的是
A.相同条件下,两容器产生的气体体积不相同
B.(1)、(2)溶液的pH值均减小
C.(1)中阳极电极反应方程式为:4OH--4e-=2H2O+O2↑
D.(2)中负极析出0.02g H2
第Ⅱ卷(非选择题 共72分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com