
题目列表(包括答案和解析)
5.下列有关物质类别判别的依据正确的是
A.原子晶体:晶体的熔点是否很高 B.电解质:水溶液是否导电
C.离子化合物:是否含有离子键 D.共价化合物:是否含有共价键
4.下列有关物质分类的说法正确的是
A.O2和O3、H2和D2、H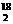 O和H
O和H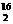 O都互为同素异形体
O都互为同素异形体
B.纯碱、烧碱、碱式碳酸铜都属于碱类物质
C.煤、石油和天然气都属于化石能源
D.CH2Cl2、CH4O、C2H4O2一定是纯净物
3.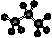 下列化学用语表达正确的是
下列化学用语表达正确的是
A.丙烷的分子结构模型示意图:
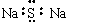 B.Na2S的电子式:
B.Na2S的电子式:
C.丙烯的结构简式:CH3CH2CH2
D.氢硫酸的电离方程式:H2S+H2O=H3O++HS-
2.已知“凡气体分子总数增多的反应一定是熵增大的反应”。一定条件下,下列反应不可能自发进行的是
A.2O3(g)=3O2(g) △H<0 B.2CO(g)=2C(s)+O2(g) △H>0
C.N2(g)+3H2(g)=2NH3(g) △H<0 D.CaCO3(s)=CaO(s)+CO2(g) △H>0
1.气体分子中的极性键在红外线的照射下,易像弹簧一样作伸缩和弯曲运动,从而产生热量。下列气体不属于温室效应气体的是
A.CO2 B.N2O C.CH4 D.N2
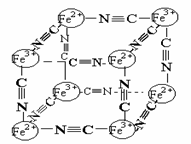 21A.(1)(2分)分析化学中常用X射线研究晶体结构.有一种蓝色晶体{可表示为:MxFey(CN)Z
},研究表明它的结构特性是:Fe2+和Fe3+分别占据立方体的点, 自身互不相邻,而CN-位于立方体的棱上.其晶体中的部分离子的空间结构关系如图示,下列说法正确的是( )
21A.(1)(2分)分析化学中常用X射线研究晶体结构.有一种蓝色晶体{可表示为:MxFey(CN)Z
},研究表明它的结构特性是:Fe2+和Fe3+分别占据立方体的点, 自身互不相邻,而CN-位于立方体的棱上.其晶体中的部分离子的空间结构关系如图示,下列说法正确的是( )
A.该晶体属于原子晶体
B.该晶体化学式MFe2(CN)6
C.M的离子位于上述立方体的体心,呈+1价
D.该晶体属于离子晶体,M呈+2价
(2)(10分)C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用。请回答下列问题:
1) Ge的原子核外电子排布式为
2) C、Si、Sn三种元素的单质中,能够形成金属晶体的是
3) 按要求指出下列氧化物的空间构型、成键方式或性质
①CO2分子的空间构型及碳氧之间的成键方式 ;
②SiO2晶体的空间构型及硅氧之间的成键方式 ;
③已知SnO2是离子晶体,写出其主要物理性质 (写出2条即可)
4) CO可以和很多金属形成配合物,如Ni(CO)4,Ni与CO之间的键型为
5) 碳氧键的红外伸缩振动频率与键的强度成正比,已知Ni(CO)4中碳氧键的伸缩振动频率为2060cm-1,CO分子中碳氧键的伸缩振动频率为2143cm-1,则Ni(CO)4中碳氧键的强度比CO分子中碳氧键的强度 (填字母)
A、强 B、弱 C、相等 D、无法判断
21B.(12分)某化学研究性学习小组探讨Fe3+和SO32-之间发生怎样的反应,请你一起参与并协助他们完成实验。
(1)提出猜想:
甲同学认为发生双水解反应:Fe3++ SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3
乙同学认为发生氧化还原反应,其反应方程式为
(2)实验验证:丙同学设计了下列实验来探究反应的可能性。
①为了检验所用的Na2SO3是否变质,应选用的试剂是
②取5mLFeCl3溶液于试管中,逐滴加入Na2SO3溶液至过量,观察到溶液颜色由黄色变为红棕色(无气泡产生,也无沉淀生成)
③将②溶液分成两等份,其中一份加入稀盐酸至过量,再加入BaCl2稀溶液,有白色沉淀生成;另一份滴入几滴KSCN溶液,溶液变为血红色
(3)得出结论:
①根据丙同学的实验得出的结论是:
②实验③中溶液变成血红色的离子方程式为
(4)拓展探究:
丁同学在FeCl3溶液中加入Na2CO3溶液,观察到红褐色沉淀并且产生无色气体。从形式上看,Na2CO3 和Na2SO3相似,但二者的水溶液与氯化铁溶液反应的现象差别很大,其原因是
08届高三第一学期期末模拟考试
20.(12分)将3.2gCu溶于amol·L-1过量的硝酸30mL中,假设硝酸的还原产物只有NO2和NO,反应结束后,将所得溶液加水稀释至1000mL,测得c(NO3-)为0.2mol·L-1。求:
(1)稀释后溶液中氢离子的物质的量浓度为 。
(2)生成的气体中NO2的物质的量为 ,NO的物质的量为 (用含a的关系式表示)。
(3)用NaOH溶液吸收氮的氧化物是防止NOx污染的一种方法。原理为:
2NO2+2NaOH=NaNO3+NaNO2+H2O; NO2+NO+2NaOH=2NaNO2+H2O
若生成的混合气体能被NaOH溶液完全吸收,则a的取值范围为 。
(4)氮的氧化物与氨气在一定条件下可以反应生成N2和H2O。若NO2与NO的混合气体平均组成可以表示为NOx,1体积NH3与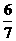 体积的NOx刚好完全反应,则x值为
。
体积的NOx刚好完全反应,则x值为
。
19.(10分)已知:HCN的结构为H-C≡N;

①R-CN RCOOH,
 ②R-Cl+CN-
R-CN+Cl-(R为烃基)。
②R-Cl+CN-
R-CN+Cl-(R为烃基)。
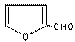 玉米芯、甘蔗渣等废物水解发酵后可制得糠醛
,它是重要的化工原料,它在一定条件下可发生以下变化:
玉米芯、甘蔗渣等废物水解发酵后可制得糠醛
,它是重要的化工原料,它在一定条件下可发生以下变化:
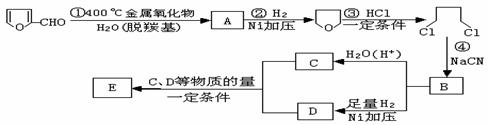
18.(8分)一定条件下,在体积为3 L的密闭容器中, 一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)。根据题意完成下列各题:
CH3OH(g)。根据题意完成下列各题:
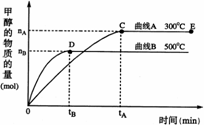 (1)反应达到平衡时,平衡常数表达式K= ,
(1)反应达到平衡时,平衡常数表达式K= ,
升高温度,K值 (填“增大”、“减小”或“不变”);
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)= ;
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是 (填字母序号)。
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
17.(10分)如下图,已知X为中学化学中的一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的最高价氧化物是耐火材料,它的晶体硬度很大,常做手表的轴承;H为单质。下图中部分反应产物已略去。
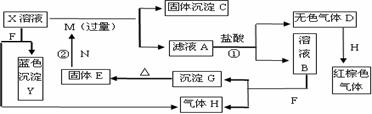
⑴红棕色气体及X的化学式分别为 、 。
⑵反应①的离子方程式为_______________________________________________。
反应②的化学方程式为_______________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com