
题目列表(包括答案和解析)
20、(12分)某温度时,水的离子积为Kw=1×10-13,则该温度(选填“大于”、“小于”或“等于”)
25℃,其理由是 。若将此温度下pH=11 的氢氧化钠溶液aL与pH=1的稀硫酸bL混合(假设混合后溶液的体积等于两者体积之和),试通过计算填写以下不同情况时两种溶液的体积比。
(1)若所得混合溶液为中性,则a∶b= ;此溶液中各种离子的浓度由大到小的排列顺序是 。
(2)若所得混合液的pH=2,则a∶b= ;此溶液中各种离子的浓度由大到小的排列顺序是 。
19、(12分)已知一定条件下的某可逆反应:A2(g)+B2(g)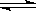 2AB(g);△H=-QkJ/mol(Q>0)。(1)在一个容积固定的容器中,充入1molA2和1molB2在同样条件下达到平衡时,反应放出的热量( )
2AB(g);△H=-QkJ/mol(Q>0)。(1)在一个容积固定的容器中,充入1molA2和1molB2在同样条件下达到平衡时,反应放出的热量( )
A、大于QkJ B、小于QkJ C、等于QkJ D、可能大于、可能小于或可能等于QkJ
(2)若在上述条件下的平衡常数K=4,则达平衡时的A2的转化率为 。
(3)若保持温度不变,在同样的容器中,充入2molA2和2molB2在同样条件下达到平衡时,反应放出的热量( )
A、大于QkJ B、小于QkJ C、等于QkJ D、可能大于、可能小于或可能等于QkJ
(4)若保持温度不变,在同样的容器中,充入1molA2和1molB2和2molAB在同样条件下达到平衡时,反应的放出的热量 (填“大于”、“等于”或“小于”)QkJ。
18、(10分)某二元酸(化学式H2A)在水中的电离方程式是:H2A=H++HA- ,HA-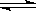 H++A2-,
H++A2-,
回答下列问题:
(1)Na2A溶液显____________(填“酸性”,“中性”,或“碱性”)。理由是__________________________(用离子方程式表示)。
(2)在0.1mol.L-1的Na2A溶液中,下列微粒浓度关系式正确的是__________
A、c(A2-) +c( HA-)+c( H2A) =0.1mol·L-1
B、c(OH-)=c(H+) +c( HA-)
C、c(Na+ )+ c(H+) =c(OH-)+ c( HA-)+2c(A2-)
D、c(Na+ )= 2c(A2-) +2c( HA-)
(3)已知0.1mol·L-1NaHA溶液的pH=2,则0.1mol·L-1 H2A溶液中氢离子的物质的量浓度可能是
0.11 mol·L-1(填“大于”,“小于”,或“等于”),理由是: ;
(4)0.1mol·L-1 NaHA溶液中各种离子浓度由大到小的顺序是: 。
|
实验序号 |
KClO3的质量/g |
A的质量/g |
反应温度/℃ |
待测数据 |
|
1 |
8.0 |
2.0 |
500 |
|
|
2 |
8.0 |
2.0 |
500 |
|
请回答:上述实验中的待测数据应是 ;
完成此研究后,他们准备发表一篇研究报告,请你替他们拟一个报告的题目:
。
17、(10分)某研究性学习小组的学生在一次活动中,设计出了如下方案来测定铜的相对原子质量:


指导老师认为此方案可行,提供了一瓶含有一定量H2SO4、Fe2(SO4)3杂质的CuSO4溶液及其他相关药品、器材。
(1)同学们首先讨论不纯的CuSO4是否要提纯。假如你是学习小组中的一员,请阐述你的看法。(结合你的意见,只需选择a、b中一题作答)
(a)需要提纯,加入 (填写试剂化学式),反应后经过滤即可提纯CuSO4溶液。
(b)不必提纯,理由是 。
(2)用铜和石墨两个电极电解CuSO4溶液时,铜电极应接电源的 极,石墨电极上的电极反应式是 ;电解的总反应式是 。
(3)该实验测得的铜的相对原子质量是 (用含m、V的代数式表示)。
|
实验序号 |
KClO3的质量/g |
MnO2的质量/g |
反应温度/℃ |
待测数据 |
|
1 |
8.0 |
2.0 |
500 |
|
|
2 |
8.0 |
2.0 |
500 |
|
16、(4分)大约有85%化学反应需要用催化剂,催化剂研究是二十一世纪化学研究的重要课题之一。
I、某中学化学小组查阅资料发现金属氧化物A也能催化氯酸钾的分解,且A和二氧化锰的最佳催化温度均在500℃左右。于是对A和二氧化锰的催化性能进行了定量对照实验,实验时均以收满500mL氧气为准(其他可能影响实验的因素均可忽略)。
15、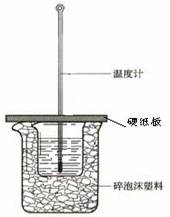 (12分)50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(12分)50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”、“偏小”、“无影响”)。
(4)实验中60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”、“不相等”),所求中和热 (填“相等”、“不相等”),简述理由
14、下表是五种银盐的溶度积常数(25℃):
|
化学式 |
AgCl |
Ag2SO4 |
Ag2S |
AgBr |
AgI |
|
溶度积 |
1.8×10-10 |
1.4×10-5 |
6.3×10-50 |
7. 7×10-13 |
8.51×10-16 |
下列说法不正确的是( )
A.五种物质在常温下溶解度最大的是Ag2SO4
B.将氯化银溶解于水后,向其中加入Na2S,则可以生成黑色沉淀
C.对于氯化银、溴化银和碘化银三种物质在常温下的溶解度随着氯、溴、碘的顺序增大
D.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动
第II卷(非选择题 共72分)
13、已知某稀盐酸的物质的量浓度为amol/L,某稀NaOH溶液的物质的量浓度为bmol/L,当两溶液等体积混合后,所得溶液的pH=2(混合溶液的体积为两溶液体积之和)。则a和b的关系是( )
A.a=b/2 B.b=a/2 C. a=b+0.01 D.a=b+0.02
12、取0.2mol/LHX溶液与0.2mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则下列说法(或关系式)正确的是( )
A.混合溶液中由水电离出的c(OH¯)<0.2mol/LHX溶液中由水电离出的c(H+)
B.c(Na+)= c(X¯)+ c(HX)=0.2mol/L
C.c(Na+)-c(X¯)= 9.9×10-7mol/L;
D.c(OH¯)- c(HX)= c(H+)=1×10-8mol/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com